个性化肿瘤学带来了希望,即每个患者的癌症都可以根据其基因组特征进行治疗。几项试验表明,有可能以足够快的速度收集基因组数据,为治疗决策提供信息。对2011-2013年间完成的I期临床试验的荟萃分析显示,总的来说,使用分子生物标记物信息来影响治疗计划的试验比没有使用分子生物标志物信息的试验结果更好。
然而,大多数精确肿瘤学治疗只使用一到两种药物,耐药克隆经常出现,强调需要以多个药物组合的方式提供个性化药物。人们已经认识到,将系统生物学和纳米材料设计相结合的重要机会是以组合的方式提供药物,以克服耐药性并结合生物效应。
图片来源: https://doi.org/10.1038/s41467-022-29154-2
近日,马里兰大学研究者们在Nature Communications杂志上发表了题为“The landscape of receptor-mediated precision cancer combination therapy via a single-cell perspective”的文章,该研究提供了对选择性和精确化靶向癌症所需靶点的身份和数量的计算估计。
在本研究中,通过挖掘大量的单细胞转录组数据,研究者使用组合优化技术来绘制癌症最佳组合治疗的图景。研究者假设每一种单独治疗都可以针对编码细胞表面受体的1269个基因中的任何一个,这些基因可能是CAR-T、结合抗体或包被纳米粒治疗的靶点。
研究者发现,在大多数癌症类型中,由最多四个靶点组成的个性化组合足以杀死至少80%的肿瘤细胞,同时保留至少90%的肿瘤微环境中的非肿瘤细胞。然而,随着要求更严格和更有选择性的杀戮,所需目标的数量迅速上升。新出现的个人靶点包括治疗脑癌和头颈癌的PTPRZ1,以及多种肿瘤类型的EGFR。
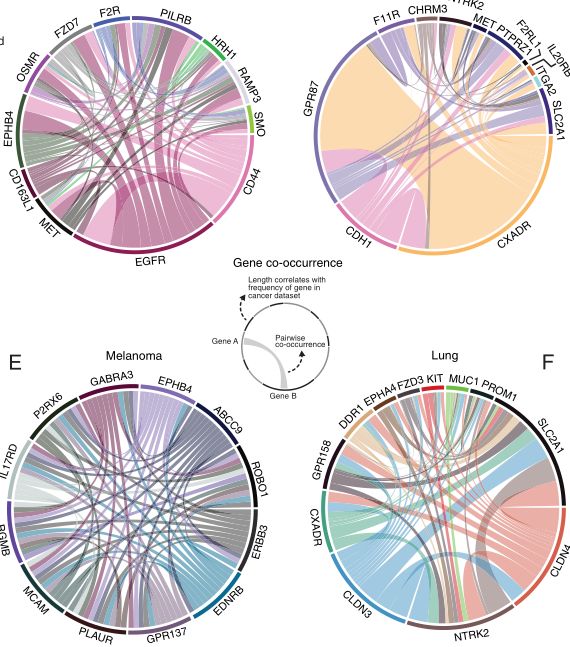
非癌人体组织中表达的基因过滤大小的函数的队列靶集(CTS)的大小和组成的变化
图片来源: https://doi.org/10.1038/s41467-022-29154-2
总之,这项研究利用组合优化工具来分析新出现的单细胞数据,以描绘癌症药物中可行的个性化组合的图景。研究者的发现揭示了未来肿瘤学药物开发的有希望的膜性靶点,这些药物可能有助于优化几种癌症类型的癌症患者队列的治疗。MadHitter方法和公开的附带软件可以很容易地应用于解决额外的根本相关的研究问题,并在获得额外的癌症数据集时进行分析。(生物谷 Bioon.com)
参考文献

尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。