肥胖会促进白色脂肪组织(WAT)的低度慢性炎症,导致胰岛素抵抗和代谢综合征,从而增加许多危及生命的疾病如II型糖尿病、心血管疾病甚至癌症的风险。脂肪性炎症的特征在于免疫细胞的募集和浸润,其中包括脂肪组织中的巨噬细胞和T细胞。来自肥胖个体的白色脂肪组织WAT中不仅有巨噬细胞数量的增加,而且巨噬细胞向表达高水平的诱导型一氧化氮合酶(iNOS)和肿瘤坏死因子(TNF)-α的经典激活M1型极化,从而驱动胰岛素抵抗。而在瘦个体的WAT中,大多数巨噬细胞表现出表达白细胞介素(IL)-10和精氨酸酶-1(Arg-1)的M2激活态,这有助于维持局部免疫和代谢稳态。通过各种方法在肥胖个体中恢复M2巨噬细胞后,有助于改善相关炎症和胰岛素抵抗。新的证据表明M2型巨噬细胞直接参与代谢稳态。最近的研究报道,在WAT中会出现褐色脂肪组织,可防止肥胖、糖尿病和代谢性疾病。有趣的是,已发现M2巨噬细胞释放儿茶酚胺以激活WAT中棕色脂肪组织(BAT)特异性解偶联蛋白1(UCP1)的表达,由此促进脂肪的燃烧消耗额外能量。
脂肪来源的干细胞(ADSCs),也称为脂肪来源的基质细胞,是间充质干细胞(MSC)在脂肪组织的基质血管部分(SVF)中的间充质干细胞(MSC)。脂肪干细胞具有多向分化为不同类型细胞的能力,如脂肪细胞、软骨细胞和成骨细胞。除了在组织修复和再生中的潜在应用之外,ADSCs还具有很强的免疫调节能力,如调节炎症或自身免疫性疾病(包括关节炎、结肠炎和自身免疫性糖尿病)。在此前,研究人员已经发现ADSCs在调控与肥胖相关的炎症和代谢紊乱中的关键作用。来自内脏的WAT的ADSC使极化的巨噬细胞向抗炎M2表型重塑,从而重塑WAT中的免疫和代谢稳态。ADSCs分泌的可溶性因子似乎也主导着M2巨噬细胞的极化。然而,ADSCs与巨噬细胞之间联系的潜在机制仍有待揭示。
外泌体是由多囊泡内体来源并由细胞分泌的纳米级囊泡。除了与外泌体相关的标志物如TSG101、CD9、CD63和CD81之外,外泌体还携带各种生物分子,包括蛋白质、脂质和RNA。通过将这些货物运输到不同类型的细胞,外泌体介导细胞间的通讯并影响生理和病理情况。 MSC被认为是外泌体的大量生产者。作为MSCs生物学作用的延伸,外泌体在生物能量学、细胞增殖和免疫调节中起作用,以旁分泌或内分泌的方式作用于临近和远端区域地区。例如,骨髓MSC来源的外泌体在动物模型中对心肌缺血/再灌注损伤(IRI)具有保护作用,并且脂肪来源的MSC和其外泌体的可联合保护肾脏免受急性IRI损伤。因此,探索ADSC衍生的外泌体在肥胖、脂肪炎症和代谢紊乱中的潜在作用是非常有意义的。
在这项研究中,来自山东大学基础医学院的研究人员发现来自WAT的ADSCs分泌外泌体使巨噬细胞向表达高水平的Arg-1和IL-10的M2极化,该过程主要依赖外泌体转移活性STAT3来实现的。值得注意的是,ADSC衍生的外泌体处理的肥胖小鼠后表现出WAT炎症的减少,改善的代谢稳态和延缓肥胖进展。ADSC衍生的外泌体在WAT中驱动M2巨噬细胞的极化,进一步促进了WAT的作用,从而产生了上述有益的效果。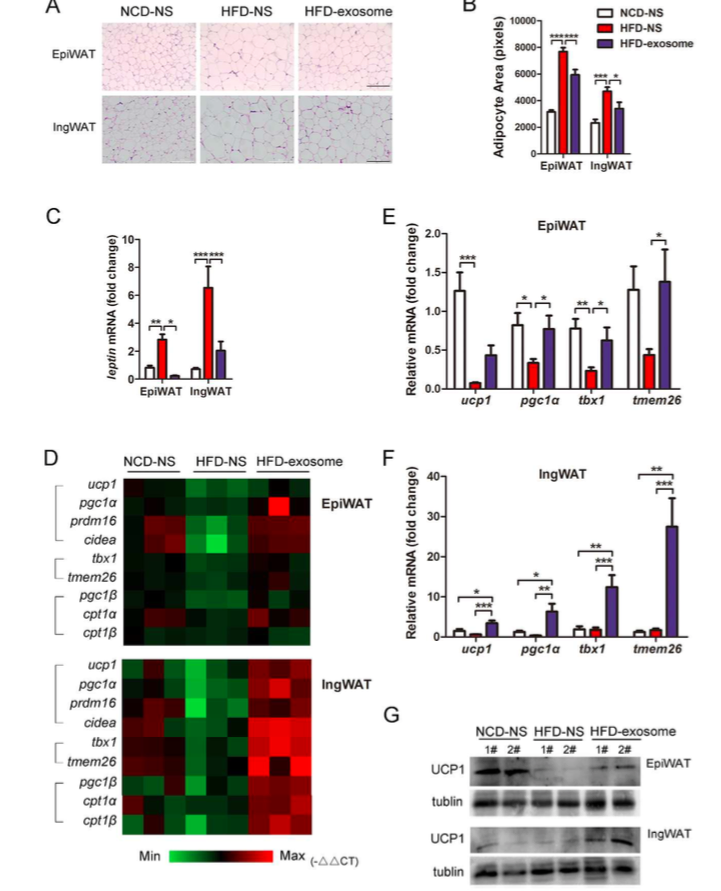
图:ADSC衍生的外泌体可改善高脂饮食喂养小鼠的WAT动态平衡。
参考文献:Zhao H, Shang Q, Pan Z, Bai Y, Li Z, Zhang H, Zhang Q, Guo C, Zhang L, Wang Q. Exosomes From Adipose-Derived Stem Cells Attenuate Adipose Inflammation and Obesity Through Polarizing M2 Macrophages and Beiging in White Adipose Tissues. Diabetes. 2017 Nov 13.
http://www.exosome.com.cn/thread-1833-1-1.html
外泌体资讯网 山东大学基础医学院:脂肪来源的干细胞分泌外泌体可减轻脂肪炎症和肥胖现象

尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。