泛素(ubiquitin,UB)分子共价结合到胞内蛋白上,进而调控该蛋白的命运,例如调控蛋白降解、改变亚细胞结构定位、调节酶的活性等等。这一过程中,UB首先被E1激活,在UB的活性半胱氨酸位点与羧基端形成硫酯键。随后E2结合UB并由E3将UB连接到目标蛋白上。起初人们认为Uba1是单一的E1,后研究发现Uba6也是一种可替代或者说非典型的E1,这两种E1在很大程度上具有重叠性,是可交互使用。后来的研究表明,Uba6在胚胎发育、神经系统发育及功能、代谢活动等过程中发挥着重要的作用。到目前为止,只有少数蛋白如RGS4、RGS5、Shank3等依赖于Uba6激活其泛素化,但Uba6如何起始泛素化的过程仍然未知。为了更好的研究Uba6在泛素化中扮演的角色,西北大学的研究人员采用正交泛素转移试验,以区分胞内Uba1与Uba6的泛素化目标蛋白。
研究策略:改造UB 使得突变型UB(xUB)不能被野生型Uba1或Uba6激活,同时改造Uba1和Uba6上UB的结合位点,使得突变型Uba1(xUba1)和Uba6(xUba6)恢复对xUB的激活能力并且丧失对野生型UB的激活能力。由此,xUB可以通过xUba1或xUba6激活并传递给E2、E3以及下游目标蛋白。在表达带FLAG标签的xUba1或xUba6细胞株中分别表达带HBT标签的xUB,使用Ni-NTA树脂及streptavidin-agarose纯化xUB连接的蛋白,随后采用质谱鉴定,筛选出Uba1或Uba6可能的激活底物。
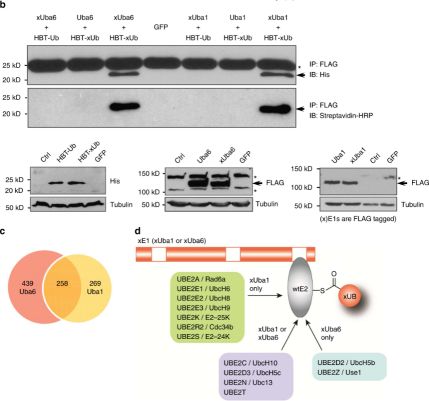
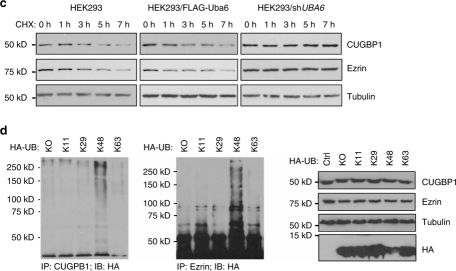
结果部分:体外实验表明,该研究体系中改造过后的xUB-xUba1/ xUB-xUba6的功能接近于wtUB-wtUba1/ wtUB-wtUba6,并且可以转移给wtUBE2D2/UbcH5b(E2)。利用慢病毒载体表达带HBT标签的xUB及wtUB,并感染HEK293细胞。实验证明在HEK293细胞内xUB-xE1与UB-E1一样具有良好的正交性。下一步纯化HBT-xUB连接的胞内蛋白并用质谱检测。在表达xUba6的细胞中鉴定出与xUB相连的蛋白有697个,在表达xUba1的细胞中鉴定出与xUB相连的蛋白有527个,其中有258个蛋白可能为xUba1与xUba6共同的底物,与之前的假设——Uba1与Uba6功能上存在重叠相一致。进一步生物信息学分析显示线粒体功能障碍、Cdc42信号传递与RhoA信号传递可能只与Uba6的底物相关,而氧化胁迫、AMPK信号传递可能只与Uba1有关。随后研究人员选取了ezrin、RNA结合蛋白CUGBP1等进行生化实验验证,结果表明ezrin与RNA结合蛋白CUGBP1确实为Uba6的底物,调节其发生K48位的多聚泛素化,从而被蛋白酶体降解。
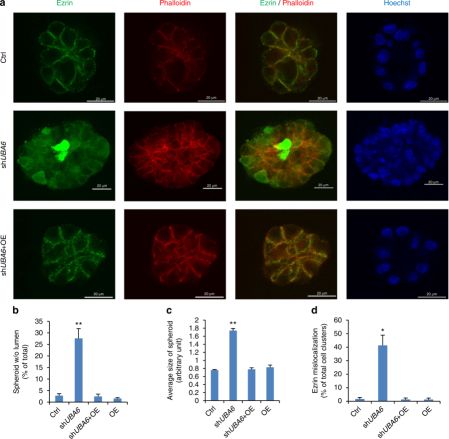
由于ezrin控制上皮细胞形态发生的基底部极性,研究人员推测Uba6引起的泛素化是否与上皮细胞腺泡的形态发生有关。MCF-10A细胞在富含层粘连蛋白基膜如Matrigel上培养时可以分化形成高度组织化的acini-like球状结构。这一体系被广泛用于研究上皮腺泡形成中各基因的功能。在MCF-10A细胞中敲除uba6以及敲除uba6并回补uba6,结果发现敲除uba6上皮细胞腺泡显著增大,并且接近30%的细胞不能形成典型的内腔结构。免疫荧光显微镜下观察可以看到,对照组细胞中ezrin在质膜上显著富集,而在uba6敲除细胞中ezrin分布较弥散。而uba6回补后能显著回复细胞的表型例如增大的球状体、ezrin亚细胞结构分布散乱等,显示Uba6对上皮细胞acini-like的形态发生具有重要的调控作用。
这项研究采用正交泛素转移技术,首次描述并且区分了两种E1——Uba1和Uba6的靶标蛋白以及相关的细胞信号传递途径,Uba1和Uba6的底物存在一定程度的交叉又各有其特异性,可能起始不同的E1-E2-E3途径从而影响特定蛋白的泛素化。同时,研究人员认为,这种正交泛素转移技术可以被进一步拓展,用于鉴定E2和E3的特异性底物,更大程度上揭示E1-E2-E3在调节不同细胞功能上发挥的作用。
值得一提的是,在蛋白质修饰和表观遗传领域,景杰生物是国内唯一一家以表观遗传学和高通量蛋白质组学为核心业务的高科技企业公司,开发有全球种类最多、覆盖面最全的组蛋白修饰抗体和蛋白质修饰泛抗体以及国内工业界最先进的蛋白质组质谱平台。公司开展结合自身开发的高灵敏度蛋白质修饰类泛抗体及抗体树脂,与高通量蛋白质组学技术服务为国内外科研客户提供了优质的修饰蛋白质组学分析,为该领域的进步做出了独有的贡献。(生物谷Bioon.com)
小编推荐会议 2019临床质谱与高端医学检验发展论坛
http://meeting.bioon.com/2019CMSPMT?__token=liaodefeng
尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。