慢性阻塞性肺病(COPD)是世界上第四大死因。在一项新的研究中,来自美国阿拉巴马大学伯明翰分校的研究人员发现了一种新的之前未报告过的将慢性炎症与COPD患者的肺部损伤之间关联在一起的致病实体。相关研究结果发表在2019年1月10日的Cell期刊上,论文标题为“Activated PMN Exosomes: Pathogenic Entities Causing Matrix Destruction and Disease in the Lung”。
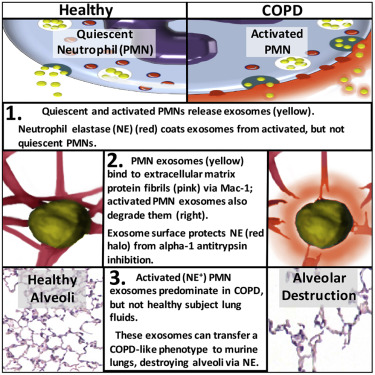
这种致病实体是由活化的多形核白细胞(polymorphonuclear leukocyte, PMN)分泌的外泌体(exosome)。外泌体是一种微小的亚细胞颗粒。当将从活化的PMN细胞收集的外泌体灌注到健康小鼠的肺部中时,它们导致COPD肺部组织损伤。值得注意的是,这些研究人员还收集了来自人类COPD患者和新生的患有支气管肺发育不良的重症监护病房婴儿的肺液中的外泌体;当将这些来自人体的外泌体灌注到健康小鼠的肺部时,它们也会引起COPD肺部组织损伤。这种损伤主要来自人肺部PMN细胞分泌的外泌体。
图片来自Cell, doi:10.1016/j.cell.2018.12.002。
论文通讯作者、阿拉巴马大学伯明翰分校肺病、过敏症与危重病医学教授J. Edwin Blalock博士说,“这份研究似乎提供了第一个证据表明一种确定的非传染性亚细胞实体在从人体转移到小鼠时能够再现疾病表型。我认为这可能是一个意义非常深远的发现。我们在这项研究中发现的很多东西将适用于其他组织,这取决于疾病。”
以免疫细胞炎症和组织破坏为特征的其他疾病包括心脏病、转移性癌症和慢性肾病。在具有由过量的PMN细胞导致的炎症的其他肺病(比如囊性纤维化)中,活化的PMN细胞分泌的外泌体也可能导致肺部损伤。
美国国家心肺血液研究所肺病科主任James Kiley博士(未参与这项研究)说,“这些研究结果突出了先天免疫反应在慢性肺病中的新作用,并且可能用于开发针对COPD和囊性纤维化的新型诊断方法和治疗方法。”
背景
COPD是一种吸烟相关疾病,其特征在于肺部PMN细胞导致的炎症。肺部损伤导致气道阻塞、呼吸短促和呼吸功能衰竭。PMN细胞,也称为中性粒细胞(neutrophil),是身体抵抗感染和组织损伤的白细胞防御的一部分。它们占身体白细胞的60%,因此每品脱血液大约含有25亿个PMN细胞。在遭受感染信号激活后,PMN细胞贪婪地吞噬微生物或受损的人细胞。
所有细胞都分泌外泌体。这些微小的膜结合胞外囊泡能够作为细胞间通信的介质,而且它们能够将不同类型的蛋白、脂质和核酸在细胞间运送。这项新研究的重点是最近发现的外泌体的第三种作用---能够携带蛋白酶。
已知活化的PMN细胞释放中性粒细胞弹性蛋白酶(neutrophil elastase, NE),即一种可降解I型胶原蛋白和弹性蛋白的蛋白酶。胶原蛋白和弹性蛋白有助于形成将细胞粘连在一起的胞外基质。在肺部,胞外基质和肺细胞有助于形成微小的肺泡,在那里,肺部交换氧气和二氧化碳。在COPD中,受损的肺泡增大,减少氧气交换并迫使心脏更努力地泵血以便将血液泵送到肺部。
NE和来自PMN细胞的其他蛋白酶能够攻击微生物。健康的肺部受到抑制这些蛋白酶的抗蛋白酶抑制因子(anti-protease)的保护。在正常情形下,NE受到肺中强大的α1-抗胰蛋白酶(alpha1-antitrypsin)屏障的抑制。
这项新的研究
Blalock及其同事们研究了NE是否可能存在于外泌体中,以及这些外泌体是否可能绕过α1-抗胰蛋白酶的抑制而导致炎症性肺病。他们发现来自静止的PMN细胞的外泌体在被转移到健康小鼠体内时不会导致COPD。相反,从肺泡的组织学变化、增加的肺阻力和将血液泵送到肺部的右心室扩大来衡量,来自活化的PMN细胞的外泌体确实导致COPD。
活化的PMN细胞分泌的外泌体覆盖有酶活性的结合到表面上的NE,而静止的PMN细胞分泌的外泌体则没有。这种表面结合的NE抵抗α1-抗胰蛋白酶的抑制作用;活化的PMN细胞分泌的外泌体降解胶原蛋白,当它们进入小鼠肺部时,它们引起肺气肿,而且它们携带PMN细胞表面标志物CD63和CD66b,这两种标志物表明它们来自PMN细胞。来自COPD患者肺部的携带这些PMN细胞表面标志物的外泌体导致小鼠患上COPD。
极大剂量的纯化NE足以破坏α1-抗胰蛋白酶屏障,从而能够导致小鼠肺泡增大。这些研究人员发现鉴于结合到外泌体表面上的NE免受α-1-抗胰蛋白酶抑制,导致相同肺部损伤所需的由活化的PMN细胞分泌的外泌体在剂量上要比纯化的NE少1万倍。
活化的PMN细胞分泌的外泌体在它们的表面上携带着整合素Mac-1是它们导致蛋白显著降解的另一个原因。整合素Mac-1允许这些外泌体直接结合到胶原原纤维上。这是除了受保护的NE之外的第二种机制,它可能解释了相比于这些外泌体的大小和蛋白酶负荷,它们具有更大的蛋白降解能力。
Blalock说,“这项研究进一步地揭示了炎症、蛋白水解和基质重塑之间的相互作用,对未来的研究产生深远的影响。我们的研究显著地扩大了外泌体的生物学特性,从而证实了这些胞外颗粒对细胞产生强大的生物学影响。”
展望未来
这项研究还提出了干扰PMN细胞分泌的外泌体的致病作用的治疗策略:(1)破坏NE与外泌体之间的离子结合,从而将NE驱逐出去并让它对α1-抗胰蛋白酶变得敏感;(2)抑制外泌体表面上的整合素Mac-1可阻断胶原蛋白结合;(3)利用小分子化合物直接抑制外泌体表面上的NE。
Blalock也对另一个重大问题---健康吸烟者的外泌体活性---感兴趣。他说,“仅七分之一或八分之一的吸烟者患上COPD。如果我们在吸烟的一小群人中发现活化的PMN细胞分泌的外泌体,那么这将会是一个令人吃惊的结果。”这些人可能应当注意他们面临的风险。
这项新的研究花了6年的时间。(生物谷 Bioon.com)
小编推荐会议 2019(第四届)外泌体与疾病研讨会
http://meeting.bioon.com/2019Exosomes?__token=liaodefeng

尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。