尽管人们认为离婚、丧亲之痛和失业是人生中的大事,但也许没有什么变化能像他们出生时那样充满戏剧性。当婴儿离开产道时,新生儿失去胎盘支持,呼吸系统和肠道必须开始发挥功能。此外,婴儿遇到的有益微生物和致病性微生物将竞争着在他们的体内定植。在一项新的研究中,Marcus Fulde等人报道肠道受体蛋白TLR5参与积极地塑造新生小鼠肠道微生物群落(也称作肠道菌群)的长期组成[1]。
肠道中的细菌定植通常始于产道[2]。随后,在肠道菌群变化期间,微生物物种的增加和减少连续地发生,其中在人类中,这一变化持续大约18个月的时间[3]。生命早期的营养状况和免疫系统发育都会影响肠道定植,这将对随后的生长和健康产生深远的影响。可悲的是,全球有1500多万5岁以下的儿童遭受营养不良和严重消瘦。这是由卡路里摄入不足和一种与肠道内细菌异常定植有关的被称作环境性肠病(environmental enteropathy)的免疫功能障碍共同导致的。被称为B细胞和T细胞的免疫细胞要能够正常地发挥功能部分上取决于它们在早期发育期间接触的非致病性微生物,这是因为这种接触对肠道菌群中的微生物物种组成和随后对致病性微生物攻击的抵抗性产生长期影响[4]。
新生幼崽的不成熟的脆弱的免疫系统在某种程度上能够得到通过胎盘转移而来的或母乳中存在的母体抗体的保护---这是一种特别有效的促进健康的手段。存留在肠道中的母乳抗体能够有助于确定定植在肠道中的微生物组成,从而阻止对非致病性微生物产生过度的免疫反应[5][6]。然而,尽管存在这种母体提供的免疫保护,但是当身体内部表面和外部表面中的微生物渐进性定植与免疫系统的发育和成熟同时发生时,婴儿仍然在早期生活中处于一个极其敏感的时期。
当无菌的动物遭受菌群定殖时,它的几乎每个器官的细胞组成和功能都会发生变化。这些变化是由来自这些微生物本身的分子触发的,并且这些结果能够有助于阻止炎症产生,这是因为动物适应了微生物在它们的体表上的存在。
人们之前认为,基于将微生物群引入到无菌条件下培养的成年动物中的实验,宿主组织对肠道微生物的存在的适应可有效地在任何年龄发生。然而,人们越来越意识到,随着新生动物的发育,一系列有序的与年龄相关的相互关联的免疫和微生物检查点是正确地适应所必不可少的,而且也会确保一种健康的菌群组成[7]形成。在这个关键的早期时间窗口的适应性例子包括调节不同类别的抗体产生和肠道中被称作自然杀伤T细胞的免疫细胞的数量[7][8]。新生动物中的微生物定植并不是先天性免疫系统发育必需的,这是因为从胎盘转移而来的和母乳中的源自母体微生物的分子就足以促进这一过程中的一些步骤发生 [9]。
之前对缺乏TLR5(属于一个与微生物识别相关的蛋白家族)的小鼠的多项研究[10][11][12]已报道这些小鼠中的肠道微生物存在着引发代谢异常(比如体重增加和肝脏中的脂肪变化)的缺陷。为了研究产后发育如何影响肠道微生物群落的建立,Fulde及其同事们比较了3天大小鼠和成年小鼠的肠道上皮细胞中的基因表达,发现编码TLR5的基因在幼鼠中高度表达。这些研究人员研究了这种蛋白是否在出生后的早期肠道发育中起作用。
Fulde及其同事们证实TLR5在生命早期的肠道上皮细胞中的表达是发育过程中的一个检查点的例子,这个发育过程与微生物定植相协调,从而实现宿主与它的菌群之间的健康共生。 TLR5能够结合到一种被称作鞭毛蛋白的细菌蛋白上,而且这些研究人员发现这会促进抗菌蛋白Reg3γ分泌。TLR5和Reg3γ都有助于限制表达鞭毛蛋白的细菌的早期定植,其中鞭毛蛋白是有助于细菌运动的鞭毛结构的一个组成部分。鞭毛蛋白存在于某些致病菌上,但并非所有表达鞭毛蛋白的细菌都具有致病性。在接受相同的含有鞭毛的沙门氏菌菌株和不含有鞭毛的沙门氏菌株混合物定植的幼鼠(最多10天大)中开展定植实验时,他们确定了这种与TLR-5相关的效应在发育期间的何时会发生。在野生型小鼠中,缺乏鞭毛蛋白的沙门氏菌菌株的肠道定植效果始终高于含有鞭毛蛋白的沙门氏菌菌株的肠道定植。这种差别在缺乏TLR5的小鼠中并没有观察到(图1)。
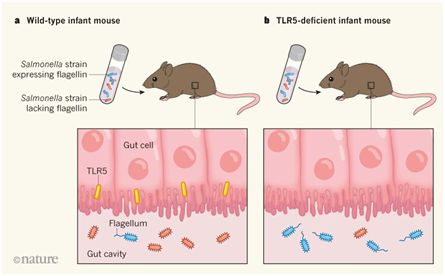
图1.一种宿主蛋白影响肠道微生物的组成,图片来自Nature, doi:10.1038/s41586-018-0395-5。
在Fulde及其同事们开展的另一种实验方法中,无菌的野生型幼鼠接受来自野生型小鼠的“健康”菌群或来自缺乏TLR5的小鼠的 “失调”菌群在肠道中的定植,其中缺乏TLR5的小鼠易于触发与代谢疾病相关的变化[10][11][12]。Fulde等人发现野生型幼鼠促进定植在肠道中的失调菌群的种类组成向来自野生型小鼠的菌群转变。然而,TLR5似乎仅在出生后的一个特定时间窗口内塑造菌群组成,这是因为这些研究人员发现当将这种失调菌群转移到无菌的缺乏TLR5的幼鼠或无菌的野生型成年小鼠中时,TLR5并不那么有效地塑造失调菌群的组成。一旦菌群组成被塑造,它就会持续很长时间一直延续到成年时期(至少42天)。鉴于断奶(出生后约21天)时肠道上皮细胞下调TLR5表达,这种菌群塑造效果的机会窗口限制在出生后的生命早期。
给定动物品种中的肠道微生物组成会随着用来培养实验室动物的住房设施不同甚至会随在同一个住房设施中的笼子不同而发生很大的变化,即使在连续的近交群体(inbred colony)中,微生物组成也会逐代地发生变化。外部影响,如饮食变化或与笼子相关的环境影响,可能会带来让实验结果混乱的变化。解决这个问题的一种方法是培育杂交动物(那些仅在目的基因的两个拷贝中的一个拷贝上发生突变的动物),然后比较缺乏目的基因的或野生型的同窝出生动物的肠道微生物。然而,正如其他人所报道的[13]那样,通过这种方法,肠道微生物组成的差异主要是由从亲代传递给后代的菌群造成的,而不受后代是否缺乏特定基因(如编码TLR5的基因)的影响。
然而,在Fulde团队研究的肠道微生物和产后发育阶段的背景下,这些研究人员不仅证实缺乏TLR5的小鼠产生异常的肠道微生物群落,而且TLR5在肠道细胞中的存在足以通过限制鞭毛细菌的存在来促进这种异常的肠道微生物群落趋向更加正常的菌群组成。
与每种重大进展一样,一些问题仍然存在。在存在或不存在TLR5的情况下确定不同微生物占据肠道微环境的方式将需要使用一系列具有事先确定的稳定的微生物组成的小鼠群体开展研究。这将允许科学家们发现微生物物种的存在与否如何影响宿主中的菌群相互作用,并通过使用一种被称作稳定同位素示踪的技术来评估微生物物种之间的分子交谈是否影响菌群的总体组装。(生物谷 Bioon.com)
小编推荐会议 2019(第五届)肠道微生态与健康国际研讨会
http://meeting.bioon.com/2019MicIntestin ?__token=liaodefeng

尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。