人们在20世纪60年代后期首次描述了在哺乳动物组织或液体中,有囊泡在细胞周围存在。1983年,Pan和Johnstone从网织红细胞培养液中发现了一种膜性小囊泡,就此打开了外泌体世界的大门,1987年Johnstone将其命名为"外泌体(exosome)"。2011年,人们提出通用术语“胞外囊泡(extracellular vesicle)”来定义所有的由脂质双层包围的胞外结构,外泌体是胞外囊泡中的一种类型。

图片来自Frontiers in Genetics, 2018, doi:10.3389/fgene.2018.00092。
人们最初认为外泌体分泌是细胞清除不想要的蛋白的一种机制。然而,20世纪90年代后期的研究表明,它可以起到细胞间通讯的作用,特别是在免疫反应和癌症中。对这一概念的强烈支持出现在2007年,在那一年,瑞典科学家Jan Lötvall领导的一个研究小组发现了外泌体内部含有mRNA和microRNA。而且,体外实验表明这些mRNA能在靶细胞中翻译表达为蛋白,从而第一次提供证据证明细胞分泌的外泌体含有mRNA和microRNA,可以转移这些遗传物质到其他细胞中。这一非凡的发现不仅指示一种新形式的细胞间通信,而且还表明就意义上而言,外泌体的行为表现类似于病毒,因为它们携带遗传信息,而且这些遗传信息能在它们“感染”的细胞中翻译为蛋白。
1.外泌体形成
大多数类型的细胞都会分泌外泌体。外泌体的尺寸小:直径大约150纳米或者更小。它们形成于细胞内称为多泡体(multivesicular body, MVB)---也称为多泡核内体(multivesicular endosome, MVE)-的区室中。
外泌体的形成过程包括以下几个步骤:第一步是多泡体向内出芽形成小的内囊泡,这些内囊泡含有蛋白、mRNA和miRNA。当多泡体与细胞膜融合时,这些内囊泡作为外泌体被释放到胞外。或者,多泡体能够与溶酶体融合,而溶酶体能够降解多泡体中包含的物质。一旦外泌体到达它们的目的地,而目的地通常是由外泌体表面上的特异性配体决定的,这样外泌体能够以两种途径进入靶细胞:通过靶细胞胞吞作用摄入到细胞内,或者通过融合到靶细胞膜,从而直接释放它包含的物质到细胞质中。细胞也分泌其他膜来源的胞外囊泡,比如核外颗粒体、脱落的囊泡或微泡,它们也是直接从细胞膜出芽产生的。已知这些囊泡也携带活性的蛋白质和RNA以及一些以前从未在外泌体中描述过的化合物,但是它们对距离较远的组织的影响人们知之甚少。

图片来自The Scientist/Keith Kasnot。
2.外泌体功能
根据分泌外泌体细胞的类型和生理状态,外泌体与它的受体细胞相互作用诱导的变化能够差异很大,要么能够有助于防御疾病,要么在一些情况下恶化疾病。比如,成熟的树突细胞分泌的外泌体携带抗原,或者嵌入在它们的脂双层中的MHC-肽链复合体,能够诱导抗原特异性的免疫反应。另一方面,在免疫抑制试剂存在的培养物中,小鼠树突细胞分泌的外泌体能够促进免疫耐受性。类似地,非病原性的分枝杆菌感染的巨噬细胞释放的外泌体携带细菌抗原,然后被其他的抗原呈递细胞摄取从而促进免疫反应。相反地,病原性的分枝杆菌菌株感染的巨噬细胞释放的外泌体抑制巨噬细胞激活和细胞因子释放,因而抑制将由分枝杆菌抗原诱导的免疫反应。这种致病菌在外泌体通信层次上似乎已进化以便有利地控制宿主的免疫系统,尽管其中的细节仍然有待阐明。
癌细胞分泌的外泌体携带来自肿瘤的抗原,能够被树突细胞捕获并被用来呈递肿瘤抗原,从而激活针对这种癌症的免疫细胞。然而,这些外泌体也含有各种各样的免疫抑制分子,而且这些分子要么能够使得T淋巴细胞或自然杀伤细胞失活,要么促进抑制免疫反应的调节性T淋巴细胞或骨髓细胞(myeloid cell)的分化。人们仍不清楚这些相互对立的影响的净效应对患有癌症的个人而言是有益性的还是有害的。几个研究小组的研究结果已经表明肿瘤分泌的外泌体通过抑制抗肿瘤免疫反应,或者通过在肿瘤转移过程中促进血管生成或肿瘤迁移到身体其他部分的方式,从而促进肿瘤的生长。
最近,Mauro Poggio等人发现对于许多对免疫疗法产生抵抗性的肿瘤来说,这些肿瘤通过将外泌体将PD-L1传递到淋巴结中来躲避免疫系统,它们在淋巴结中远程抑制免疫细胞的激活。外泌体携带的PD-L1不是关闭肿瘤表面的免疫反应,而是在外泌体通过淋巴系统或血液到达淋巴结之前抑制免疫细胞,从而使得肿瘤对现有的免疫检查点抑制剂具有抵抗性。
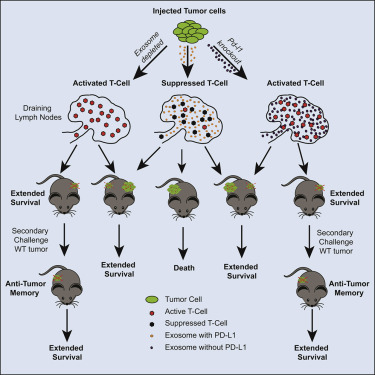
图片来自Cell, 2019, doi:10.1016/j.cell.2019.02.016。
其他组织或细胞也分泌携带免疫抑制分子的外泌体。比如,胎盘来源的囊泡携带针对自然杀伤淋巴细胞和其他免疫系统组分的抑制性配体,从而可能阻止对胎儿的免疫攻击。类似地,支气管肺泡液体中存在的外泌体和其他囊泡能够将对一种过敏原的抵抗性转移给其他动物。当从已经耐受某种过敏原的小鼠中纯化的外泌体注射进天然小鼠,这些对该过敏原敏感的小鼠也对该过敏原引发的过敏反应产生抵抗性。另一方面,支气管肺泡液体中的外泌体也能够增强促炎症反应,因为当从哮喘病人中纯化的外泌体同支气管上皮细胞一起培养时,支气管上皮细胞作出反应,分泌出促炎症的细胞因子。
近期,Kristopher Genschmer等人当将从活化的多形核白细胞(polymorphonuclear leukocyte, PMN)收集的外泌体灌注到健康小鼠的肺部中时,它们导致在慢性阻塞性肺病(COPD)患者中观察到的肺部组织损伤。值得注意的是,这些研究人员还收集了来自人类COPD患者和新生的患有支气管肺发育不良的重症监护病房婴儿的肺液中的外泌体;当将这些来自人体的外泌体灌注到健康小鼠的肺部时,它们也会引起COPD肺部组织损伤。这种损伤主要来自人肺部PMN细胞分泌的外泌体。
此外,Stephen E. Flaherty III等人发现脂肪细胞不仅释放出甘油三酯中的脂肪酸成分,它们还释放出包装成小颗粒的完整甘油三酯。这些称为脂肪细胞外泌体(adipocyte exosome, AdExo)的填充着脂质的颗粒被脂肪组织中的巨噬细胞摄取。巨噬细胞快速地降解AdExo中的甘油三酯并释放出脂肪酸。这些发现表明AdExo似乎控制着免疫细胞的发育。
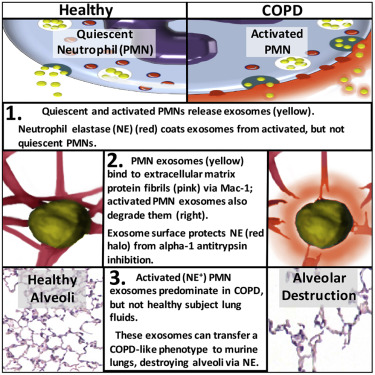
图片来自Cell, doi:10.1016/j.cell.2018.12.002。
人们还已发现,真核生物的寄生物或致病菌分泌外泌体,其中这些外泌体能够有助于宿主产生对入侵者的耐受性(通过抑制免疫反应),或者,相反地,促进宿主在入侵者存在时产生病理性炎症反应。
除了免疫系统之外,外泌体可能影响其他的生理功能。神经细胞、上皮细胞、肌细胞和干细胞分泌的外泌体可能存在的功能包括促进组织修复、神经系统内通信以及诸如朊病毒蛋白和淀粉样沉积之类的病理性蛋白质的形成和转移。比如,神经元分泌携带神经传递质受体的外泌体,因而能够参与胞外空间的神经传递质的清除从而阻止信号传导,而且/或者传递这些受体到其他细胞,从而使得它们对神经传递质作出反应。
3.外泌体研究存在的局限
人们已观察到在各种细胞类型中,大小与外泌体一样或更大的胞外囊泡是从细胞主体的质膜或膜延伸物(比如微绒毛、丝状伪足,纤毛和鞭毛)出芽而形成的。大小与外泌体相当的胞外囊泡在大小、密度和膜定位方面具有与外泌体相同的生物物理特征,因此,目前的方法无法有效地将它们区分开来。
细胞释放出的源自多泡体的外泌体与其他小型胞外囊泡的相对比例是高度可变的,取决于细胞类型、环境条件和其他因素(比如感染或人工诱导分子表达),而且通过当前的大多数实验方法制备出的外泌体可能含有内体起源的小型胞外囊泡(也就是外泌体)和非内体起源的小型胞外囊泡,以及其他的基于脂质的非囊泡结构(比如多种密度的脂蛋白,即中密度脂蛋白、高密度脂蛋白、低密度脂蛋白和极低密度脂蛋白)和新鉴定出的外泌颗粒(exomere)。近期,富含晚期内体组分的外泌体被定义为一种带有四跨膜蛋白CD63(一种在多泡体中堆积的蛋白)和CD9/CD81(主要存在于质膜上)的小型胞外囊泡亚型,不过这种定义还需在其他的细胞中和在其他的条件下进行验证。在包括癌症、免疫反应、心血管疾病、再生和干细胞疗法在内的许多病理生理情况下,胞外囊泡发挥着许多功能。尽管许多研究将这些功能描述为是外泌体特有的,但是人们已发现许多外泌体制备物存在潜在的多种亚细胞起源,这表明多种胞外囊泡类型具有更广泛的功能相关性。
对胞外囊泡兴趣的增加与它们引发受者细胞表型变化的能力有关。胞外囊泡的尺寸和/或表面组分的差异很可能影响靶细胞对它们的识别和捕获。比如,微胞饮(micropinocytosis)在理论上能够捕获分离的外泌体和小型胞外囊泡,但是不能捕获太大的胞外囊泡或小型胞外囊泡聚集体。鉴于人们才开始意识到胞外囊泡的多样性,因此在它们到达受者细胞后,人们对包括外泌体在内的不同胞外囊泡亚型的命运的了解仍然有限。
近年来外泌体研究的一个重大进步是人们越来越认识到包括外泌体在内的胞外囊泡包括许多不同的颗粒亚型,而且每种颗粒亚型在细胞间通讯中都可能具有有趣的功能。尽管人们对这一领域的兴趣日益浓厚,但对控制胞外囊泡生物发生、释放、摄取和功能的细胞和分子机制的理解仍然是有限的。精确描述胞外囊泡的一个关键限制是分离和描述纯的特定颗粒亚型存在技术难度,这是因为人们当前所使用的方法导致对不同亚细胞来源的胞外囊泡进行系统性共分离。因此,尽管许多文章使用术语“外泌体”来指代通过物理过程与较大的胞外囊泡分离开来的胞外囊泡制备物,但它们很可能是指外泌体性质和非外泌体性质的小型胞外囊泡的混合物。因此,除非明确确定它们的多泡体来源,不然可能最好使用通用术语“小型胞外囊泡”。
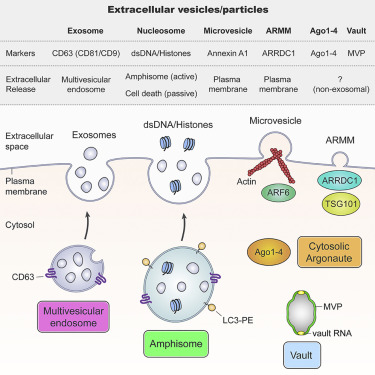
图片来自Cell (2019), doi:10.1016/j.cell.2019.02.029。
近期,Dennis K. Jeppesen等人指出采用高分辨率密度梯度分离和直接免疫亲和捕获方法来精确地描述外泌体中的RNA、DNA和蛋白组分以及其他的非囊泡物质。他们发现胞外RNA、RNA结合蛋白和其他的细胞蛋白在外泌体和非囊泡区室中发生差异性表达,而且他们并没有在外泌体中检测到Argonaute 1、Argonaute 2、Argonaute 3、Argonaute 4、糖酵解酶和细胞骨架蛋白。他们将膜联蛋白A1(annexin A1)鉴定为直接从从质膜脱落下来的微囊泡(microvesicle)的一种特异性的标志物。他们进一步发现小胞外囊泡并不是DNA积极释放的载体。相反,他们提出一种通过一种依赖于自噬和多泡核内体(multivesicular endosome)但不依赖于外泌体的机制积极分泌胞外DNA的新模型。 由此可见,这些发现表明需要重新评估外泌体的组成,这就为更清楚地了解胞外囊泡的异质性提供一种框架。
人们当前对包括外泌体在内的胞外囊泡生理学、多样性、内化和分子货物运送的了解仍然非常有限,因而无法准确地针对胞外囊泡如何与受者细胞相互作用并对它们进行修饰的机制得出结论。为了让胞外囊泡领域取得进展,有必要以综合的方式进行研究,包括分子、细胞和功能表征,从而尽可能地比较一种给定实验系统中的不同胞外囊泡亚型。这些方法对于确定哪些分子或机制对某些胞外囊泡亚型是特异性的,哪些是适用于所有胞外囊泡亚型的至关重要。(生物谷 Bioon.com)
小编推荐会议 2020(第五届)外泌体与疾病研讨会
http://meeting.bioon.com/2020Exosomes?__token=liaodefeng


尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。