PNAS:许巧兵团队开发肺靶向LNP,实现mRNA药物安全高效和特异性递送
来源:生物世界
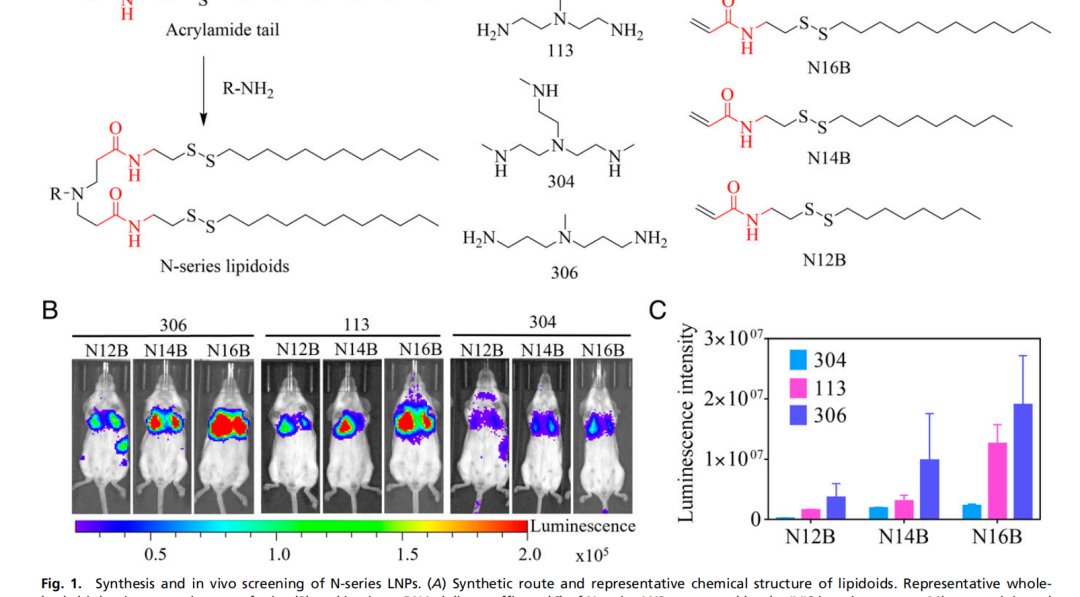
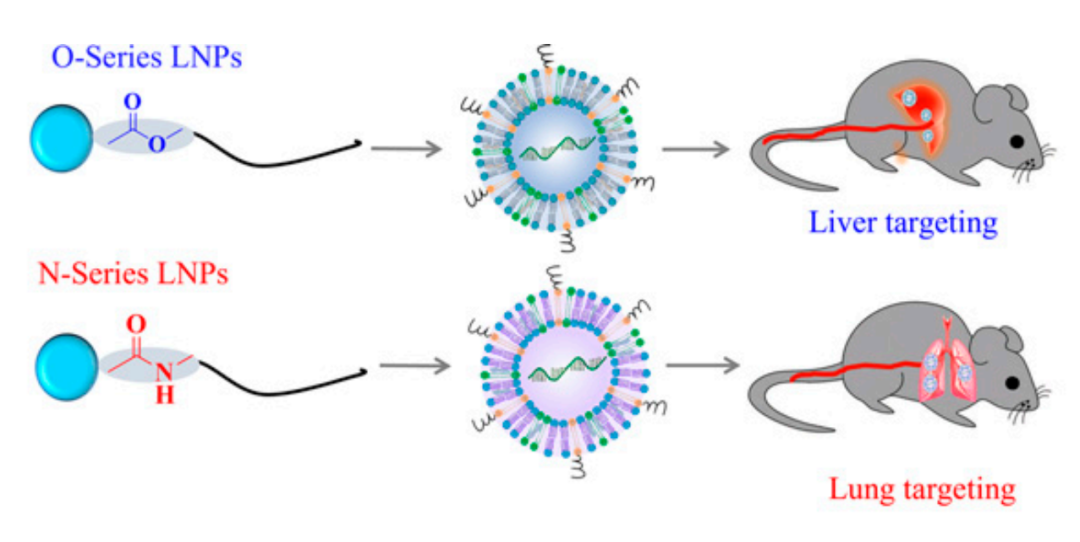
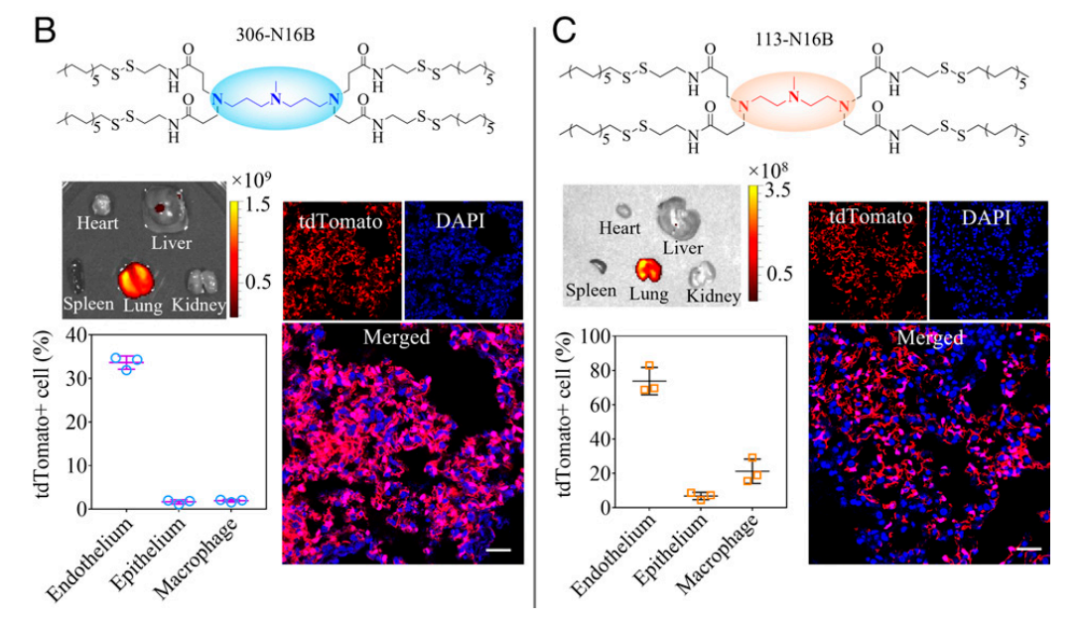
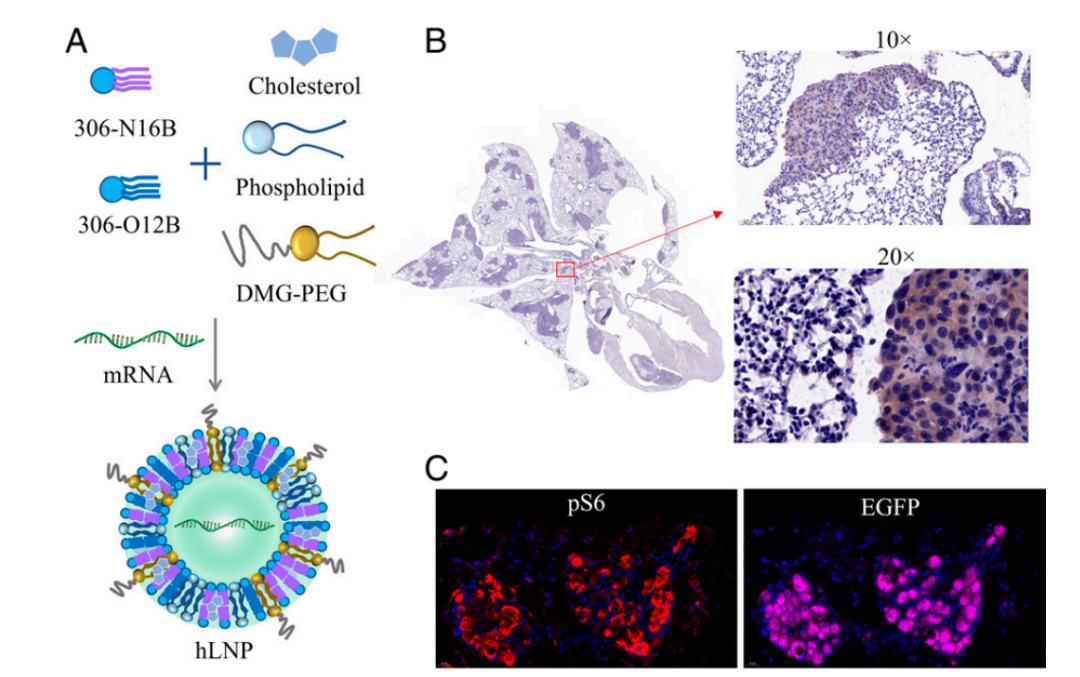
近年来,mRNA作为新型制药技术,短时间内在传染性疾病及肿瘤治疗领域取得了突破性进展。然而,如何将mRNA安全、高效地递送到特定靶细胞并保护其免于降解是目前开发mRNA药物面临的主要挑战之一。理想的递送载体必须是安全的、稳定的和器官特异性的。脂质纳米颗粒(LNP)是临床上最先进的mRNA载体。截至2021年6月,所有正在研制或批准临床使用的新冠mRNA疫苗均采用LNP递送系统。LNP为mRNA递送提供了许多好处,包括制剂简单、模块化、生物相容性好和较大的mRNA有效载荷容量。遗憾的是,临床研究表明,LNP会在肝脏积聚,因此当前的LNP递送系统大多是肝脏靶向的,肝脏以外器官(如肺和肾)的有效递送问题亟待解决。近日,美国塔夫茨大学许巧兵教授团队在《美国国家科学院院刊》(PNAS)上发表了题为:Lung-selective mRNA delivery of synthetic lipid nanoparticles for the treatment of pulmonary lymphangioleiomyomatosis 的研究论文。通过文库筛选,研究团队发现N系列的LNP(尾部含有酰胺键)能够选择性地将mRNA传递到小鼠肺中。不仅如此,他们还发现,只要简单调整N系列的LNP的头部结构(headgroup),就可以靶向不同的肺细胞类型。更重要的是,该还证明了基于LNP的mRNA治疗在淋巴管平滑肌瘤病(LAM)的临床前模型中的成功,表明LNP-mRNA是一种很有前途的LAM治疗干预手段。mRNA在全身传递后主要在肝脏和脾脏中积累,因此迄今为止的临床研究主要集中在肝脏疾病上。为了充分发挥mRNA的治疗潜力,迫切需要能够将特定的mRNA传递到肝外组织的载体。由于对纳米颗粒(NPs)与生物成分之间的相互作用的了解有限,因此难以预测新设计的LNPs在体内的靶向行为是发展靶向性LNPs的一个主要障碍。纳米颗粒被注射到血管中后,其外表面会迅速吸附一层血清蛋白,称为“蛋白冠”,它重塑了纳米颗粒的表面性质,并极大地影响纳米颗粒与器官和细胞的相互作用。更重要的是,许巧兵教授团队此前的研究已经证明脂质化合物的头部结构可以影响递送效果,甚至是mRNA负载的LNPs的体内靶向性。在最近的一项研究中,许巧兵团队发现基于咪唑的合成脂类化合物优先将mRNA靶向到脾脏【2】,但类脂尾巴结构对LNPs体内选择性的影响仍知之甚少。为了弥补这一重要的知识空白,研究团队合成了一个尾部结构含有酰胺键的类脂类(N-series LNPs)文库。令人惊讶的是,在体内筛选中,N系列LNPs经系统给药后几乎只将mRNA传递到肺部。这与之前该团队发现的O系列的LNPs(尾部含有酯键)倾向于将mRNA传递到肝脏形成对比【3】。该研究的第一作者邱敏博士(现为复旦大学PI)在文章中写道:“为了更好地理解为什么如此小的结构变化会导致如此显著的器官特异性,我们进一步研究了其潜在的靶向递送机制。我们假设,LNPs一旦被注射到血液中,会选择性地吸附特定的血浆蛋白,这些吸附在LNP表面的蛋白可以作为靶向配体,引导LNPs进入选定的器官。”通过对肝靶向(306-O12B LNP)和肺靶向(306-N16B LNP)表面蛋白冠成分进行蛋白质组学分析,研究团队发现了一组独特的血浆蛋白,这些蛋白可能对LNP的器官靶向性起到了主要作用。更重要的是,他们还发现通过改变N系列LNPs的头部结构(headgroup),就可以靶向不同的肺部亚细胞群。通过调整N系列LNPs的头部结构,可以靶向不同类型的肺细胞不仅如此,研究团队还评估了肺靶向LNPs在体内靶向递送Tsc2 mRNA到Tsc2缺陷细胞,以恢复Tsc2肿瘤抑制因子的表达,从而治疗肺淋巴管平滑肌瘤病(LAM),这是一种由双等位基因突变和TSC复合体基因功能丧失引起的罕见遗传病。hLNP使mRNA特异性递送到TTJ肿瘤细胞,治疗LAM总而言之,这项研究证明,可以通过简单的化学方法调整LNPs的蛋白冠的组成,从而调节LNPs的体内器官靶向性。这为合理设计具有高度特异性的器官和细胞选择性的mRNA-LNPs提供了新思路。