中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室海洋微生物代谢工程与生物合成研究团队在海洋微生物氧杂蒽酮生物合成机制研究中取得新进展。9月14日,相关研究成果在线发表在《自然-通讯》(Nature Communications)上。
包含氧杂蒽酮骨架的天然产物具有抗炎、抗氧化、抑菌及抗肿瘤等多种活性。自四十多年前首次报道氧杂蒽酮类化合物以来,该类部分化合物已成为药物研发的明星分子。目前,已发展了较多关于氧杂蒽酮类化合物的化学合成方法,但放线菌来源化合物的氧杂蒽酮骨架的生物合成过程和酶学机制尚不清楚。
研究团队早期在海洋小单孢菌SCSIO N60中发现了Fluostatin C (7),与kinamycin A (11)同属苯并芴类非典型角环素。前期,研究阐明fluostatin生物合成途径中的黄素氧化酶FlsO2具有双功能,能够催化氧化和脱水反应,将8形成9(图1)。基因缺失突变株△flsO2中仍可观察到少量的化合物9,暗示基因簇中的其他氧化酶可能互补FlsO2的体内功能(Org. Lett., 2015, 17, 5324)。kinamycins生物合成研究表明单加氧酶AlpJ(FlsG同源蛋白)催化9的缩环反应形成苯并芴中间体12,黄素氧化酶AlpK可能负责12的C-5位羟化形成13。前期的体内研究也发现,AlpK的同源酶FlsO1具有类似的C-5位羟化功能(J. Org. Chem., 2021, 86, 11019)(图1),但因化合物12不稳定而无法获得,从而限制了FlsO1的体外功能研究。然而,研究获得了nenestatin A生物合成中间体nenestatin C (14)(Org. Biomol. Chem., 2021,19, 4243),其结构与12类似,可作为12的模拟底物进行FlsO1的体外功能研究(图1)。
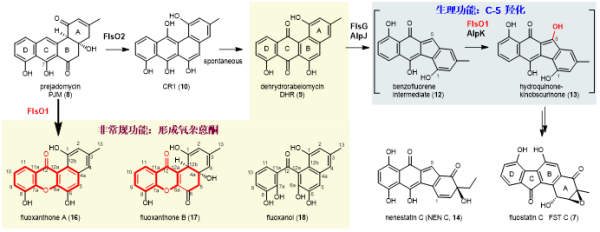

图1.多功能氧化酶FlsO1的生理功能和意外发现的新功能
基于上述工作,研究发现黄素氧化酶FlsO1能够体外催化多元氧化反应,一方面可以催化前体8形成产物9,从而回补FlsO2的生理功能;另一方面可以将8转化为多个产物,包括氧杂蒽酮化合物16和17(图1)。此外,研究通过同位素标记、中间体或其衍生物的结构鉴定等实验,阐释了FlsO1通过催化三步级联氧化反应(羟化、环氧化和Baeyer-Villiger氧化)形成氧杂蒽酮的反应机理;发现FlsO1能够催化完成14(模拟生理底物12)的C-5羟基化,间接证明了FlsO1的生理功能;通过FlsO1酶的晶体结构、关键中间体的docking分析和氨基酸残基定点突变实验,揭示了FlsO1接受不同底物,催化多元氧化反应的结构基础。
本研究发现了海洋放线菌中显著不同于真菌和植物中氧杂蒽酮环的生物合成机制,阐明了多功能黄素氧化酶FlsO1催化多元氧化反应的结构基础,拓展了黄素蛋白功能研究的视野,为氧杂蒽酮的结构多样化和构效关系研究提供了新的工具酶和研究手段。研究工作得到国家自然科学基金、海南省重大科技计划项目、国家重点研发计划、王宽诚教育基金、中科院青年创新促进会、广东省海洋经济发展专项资金项目和南方海洋科学与工程广东省实验室(广州)人才团队引进重大专项等的支持。

尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。