我们30岁后每年都会不可逆地流失1%的皮肤胶原蛋白,进而引起组织衰老和病变。为了补充流失的胶原蛋白,各种医疗技术应运而生,但多数效果无法持久和自然。
2023年1月12日,北京大学深圳研究院/深圳湾实验室Andrew Lee教授团队、德克萨斯大学安德森癌症中心Betty Y.S. Kim教授团队和中国医学科学院阜外医院兰峰教授团队合作在 Nature Biomedical Engineering 期刊发表了题为:Intradermally delivered mRNA-encapsulating extracellular vesicles for collagen-replacement therapy 的研究论文。
该研究探索出一种创新的治疗技术——细胞衍生外囊泡mRNA疗法(EV mRNA)。通过生物工程改造的增强型细胞外囊泡(EV),将胶原蛋白mRNA递送到皮肤中,促进受体皮肤细胞产生因衰老而流失的胶原蛋白。定期向有皱纹的皮肤部位注射一次,即可持续产生天然胶原蛋白。研究团队在胶原缺失的光老化模型中证实了EV mRNA用于蛋白质替代治疗的功效。

为了验证EV mRNA是否可以持久地表达胶原蛋白以达到对光老化皮肤的修复治疗,此项研究使用了小鼠急性光老化模型,模拟了人类老化损伤皮肤的病理和生理特征。研究人员构建了基于细胞外囊泡的细胞外基质I型胶原蛋白α1(extracellular-matrix α1 type-I collagen,COL1A1)mRNA药物装载系统,通过透明质酸微针(hyaluronic acid microneedle,COL1A1-EV MN)贴片将胶原蛋白mRNA递送到真皮层。
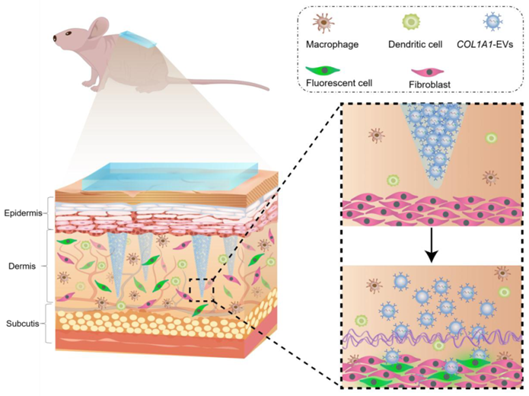
细胞衍生的mRNA创新疗法在小鼠急性光老化模型的应用示意图
研究团队发现:
1、细胞纳米穿孔(Cellular nanoporation,CNP)技术能够将超过传统方法1000倍拷贝数的COL1A1 mRNA装载到EV中。CNP制备的EV在4℃储存时结构稳定,封装在EV内的COL1A1 mRNA在室温和4℃下同样稳定,且表现出血清稳定性,突显了其未来临床应用的潜力。
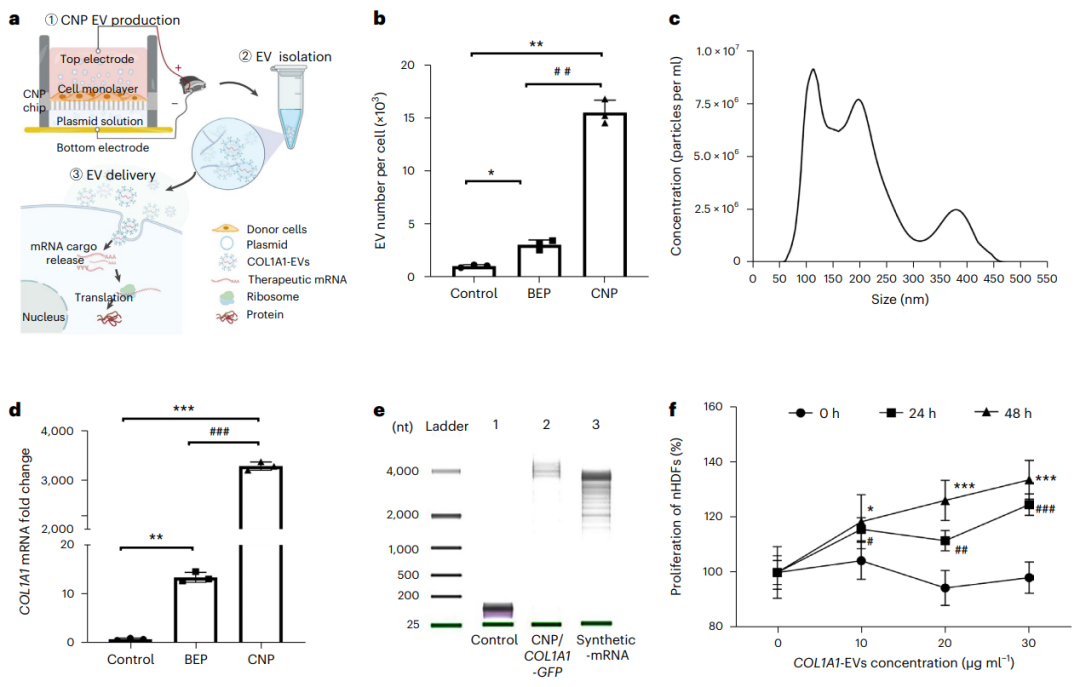
CNP可产生大量装载COL1A1 mRNA的EV
2、低剂量直接注射给药后,30天内可实现并维持胶原蛋白替代;而通过微针(Microneedle,MN)递送的EVs则会更好地分散在真皮层和皮下,胶原蛋白持久时间更长,起始剂量下即可在长达70天的时间内大幅减少皱纹。
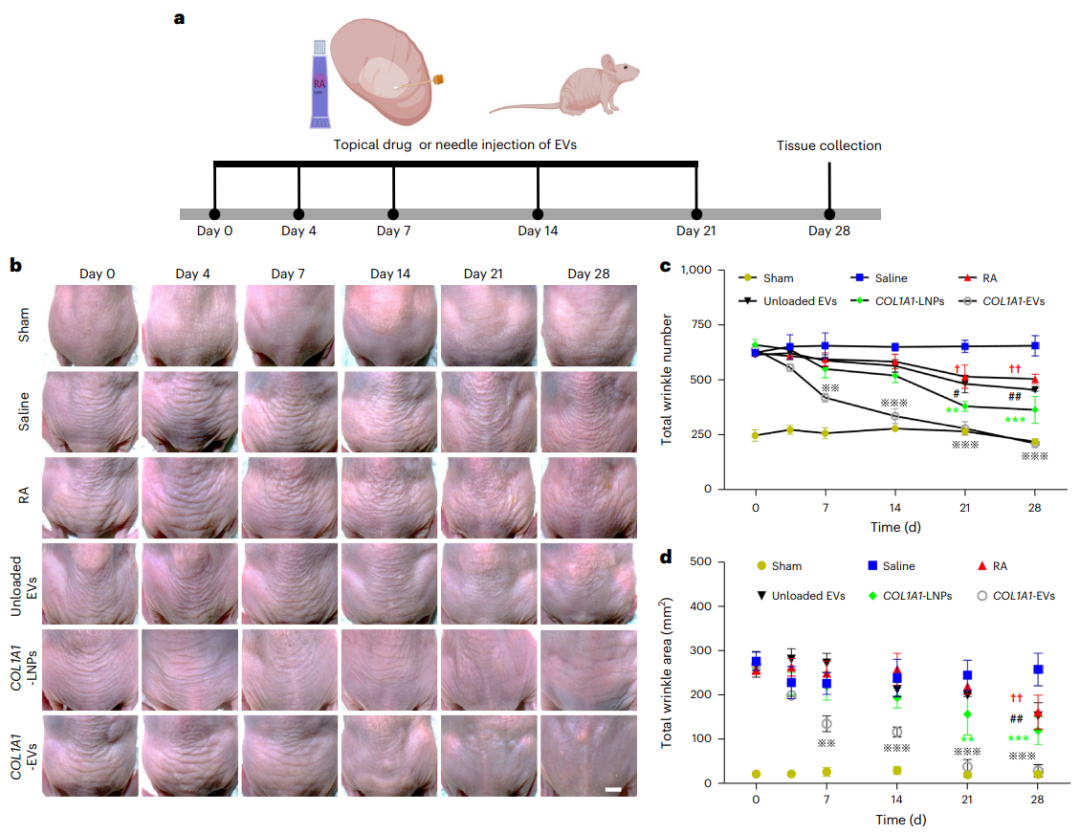
COL1A1-EV mRNA的递送减少了皮肤皱纹
3、COL1A1-EV和COL1A1–LNP处理的小鼠皮肤皱纹数量和面积显著减少,且有更高的弹性和紧致度。然而和COL1A1-EV mRNA治疗的皮肤相比,经过COL1A1–LNP 处理的皮肤出现红肿,且组织中检测到了大量的炎症因子,表现出强烈的炎症反应。这些发现表明EV的免疫原性显著低于LNP。
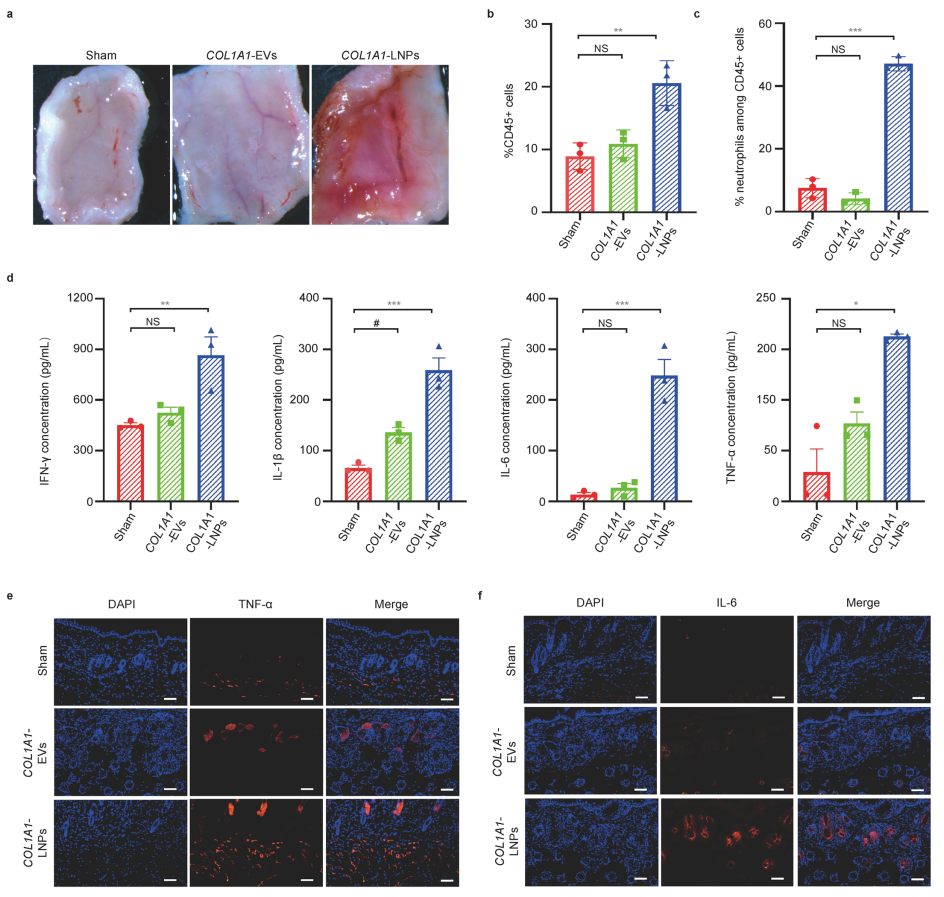
COL1A1-LNP引起局部组织炎症
该研究证明了以EV为基础的mRNA递送在光老化模型中用于胶原蛋白替代和抗衰老治疗的临床潜力。EV mRNA的递送代表了一种新的通用基因治疗方式,在治疗随着衰老或其他疾病发生的人体蛋白质损失方面具有巨大潜力,特别是蛋白质缺失或表达不足导致的罕见遗传性疾病以及肿瘤。
与用于新冠mRNA疫苗(Moderna/BioNTech/Pfizer) 的LNP相比,EV mRNA递送系统具有较低的免疫原性和较低的毒性。LNP在递送mRNA到组织中时会引起明显的炎症,限制了其治疗效果。
目前,AAV是进展较快的体内基因治疗载体,已有多个相关药物获得 FDA批准。然而,由于AAV利用了病毒主体,存在显著的免疫原性、细胞毒性以及潜在的基因组整合相关风险,综合导致了多项临床试验失败。此外,AAV体积限制其搭载基因数量(只有约20%的人体基因能够被AAV所容纳),且由于中和抗体的存在,患者通常无法接受重复给药。相比之下,EV mRNA递送系统在安全性,装载体积方面均有优势,更重要的是,它可以重复多次使用而无临床排斥反应。
据悉,该研究的COL1A1-EV系统预计将在2023年开展首次人体试验,以测试该递送系统及产品在人体中的安全性和耐受性。在相关研究团队看来,虽然EV在人类临床应用中仍存在许多挑战,但其与LNP和AAV相比明显具有更好的生物相容性和安全性,加之EV MN系统提升了递送mRNA的综合能力,EV作为通用核酸药物载体治疗人类疾病的潜力将会得到充分释放。
尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。