由于其相对较高的发病率和死亡率,乳腺癌仍然是全世界妇女的主要威胁。转移的发生是导致乳腺癌患者治疗失败和死亡的主要原因,也是乳腺癌临床治疗的一大挑战。肿瘤转移极其复杂,不仅需要肿瘤细胞进化出更强的侵袭和转移能力,还需要诱导良好的微环境来促进肿瘤细胞的定植和生长。
越来越多的证据表明,转移的生态位是肿瘤细胞从原发部位转移到远端区域所必需的。转移的生态位的特征是血管生成、淋巴管生成、炎症、血管通透性、免疫抑制、器官排斥和重新编程。
血管生成对于建立转移性微环境,进而促进肿瘤细胞外渗、内渗、存活、增殖和转移生长至关重要。然而,在转移的生态位形成过程中调节这一过程的潜在机制仍然知之甚少,因此需要阐明。

图片来源: https://pubmed.ncbi.nlm.nih.gov/35673569/
近日,来自天津医科大学肿瘤研究所和医院的研究者们在Theranostics杂志上发表了题为“Exosomal EPHA2 derived from highly metastatic breast cancer cells promotes angiogenesis by activating the AMPK signaling pathway through Ephrin A1-EPHA2 forward signaling”的文章,该研究的发现确定了一种新的机制,即胞外EphA2介导的细胞间通讯从乳腺癌细胞到肿瘤微环境中的内皮细胞,从而刺激血管生成和转移。靶向外泌体EphA2-AMPK信号通路可能成为乳腺癌治疗的一种潜在策略。
研究者首先从高转移潜能(HM)和低转移潜能(LM)的乳腺癌细胞中分离出外泌体。通过体外试管形成实验、创面愈合实验、大鼠动脉环萌发实验和体内Matrigel Plug实验评价这些外切体的促血管生成作用。
随后,通过RNA测序、shRNA介导的基因敲除、不同EphA2突变体的过表达以及小分子抑制剂等方法分析外体EphA2的促血管生成作用及其可能的下游机制。最后,用表达不同水平EphA2的肿瘤细胞模拟体内肿瘤细胞分泌外切体建立移植瘤模型,并利用IVIS光谱成像系统和CT监测肿瘤细胞的转移情况。
在本研究中,研究者证明了HM乳腺癌细胞产生的外泌体可以促进血管生成和转移。EphA2富含HM来源的外泌体,具有促血管生成作用。外泌体EphA2可以从HM乳腺癌细胞转移到内皮细胞。
此外,它还能在体外刺激内皮细胞的迁移和成管能力,在体内促进血管生成和肿瘤转移。从机制上讲,外泌体EphA2通过配体EPhin A1依赖的典型正向信号通路激活AMPK信号。此外,抑制AMPK信号会削弱外泌体EphA2介导的促血管生成作用。
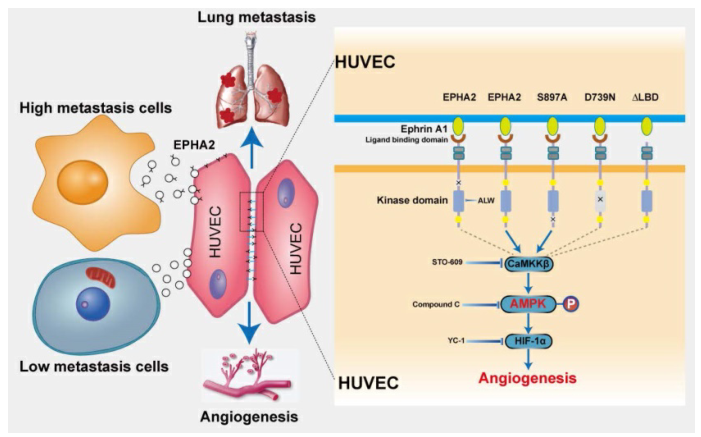
本研究机制的示意性模型
图片来源: https://pubmed.ncbi.nlm.nih.gov/35673569/
综上所述,本研究结果证实了富含EphA2的外泌体在促进乳腺癌血管生成和转移中的关键作用。从HM乳腺癌细胞转移到内皮细胞的外泌体EphA2通过依赖于配体EPhin A1的正向通路激活AMPK信号,从而实现促血管生成的作用。
因此,本研究确定了一种新的机制,即外体EphA2介导的乳腺癌细胞与肿瘤微环境中的内皮细胞之间的细胞间通讯,从而刺激血管生成和转移。外泌体中高水平的EphA2与癌症进展有关,并提示乳腺癌患者的临床预后较差。
因此,EphA2是乳腺癌预后不良和进展的一个潜在的有效生物标志物,靶向EphA2-AMPK信号通路可能成为乳腺癌治疗的潜在策略。(生物谷 Bioon.com)
参考文献
尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。