一句“我思故我在”解释了大脑的重要性。随着全球老龄化的加剧,神经退行性疾病的发病率也随之增加。“老年痴呆”、“帕金森”等神经退行性疾病更是和癌症一样,成为数不多流传在街头巷尾的“医学名词”。
从近代科学诞生一来,人类对于大脑的研究,始终未曾断绝,且始终处于生命科学的前沿领域。然而,大脑样本的稀缺性和珍贵性限制了大脑体外研究的发展。而基于干细胞技术发展而来的大脑类器官给大脑研究提供了新的契机。
10月12日,来自斯坦福大学的神经科学家帕斯卡领导其团队在国际顶级期刊Nature在线发表了题为《Maturation and circuit integration of transplanted human cortical organoids》关于大脑类器官的最新研究性文章。在这项研究中,研究人员将来自于人的多能干细胞经诱导分化为大脑皮质类器官后原位移植于新生无胸腺大鼠的体感皮层中,构建了人鼠混合大脑类器官——t-hCO。这种类器官不仅可以在大鼠体内正常生长,展现了正常的大脑生理结构,还可以参与大脑控制行为的神经环路,为大脑神经退行性疾病研究和新药开发提供了新的策略。

人类大脑发育过程是一个复杂的过程,其中神经元增殖、分化、迁移和连接以形成功能性神经环路的机制和过程仍有待研究。近年来,大脑类器官培养技术的发展使得研究人员可以对特定脑区的发育过程和功能进行研究。然而,已有的大脑类器官并没有产生行为输出的神经环路,限制了其在神经类疾病方面研究的发展。
为了解决上述问题。在这项研究中,研究人员将体外诱导分化产生完整的三维脑类器官hCO定向移植到出生后3-7天的无胸腺大鼠的脑部S1区中(负责处理触觉信息的初级感觉区域称作体感带(S1区),位于顶叶前部),并在移植后2-3个月对大鼠脑部进行MRI成像,观察t-hCO的生长状态。结果表明,在体移植后的t-hCO在3个月内体积增加了9倍,而移植12个月后,移植动物存活率为74%,并且没有明显的运动和记忆缺陷、神经胶质细胞增生或脑电图(EEG)异常。
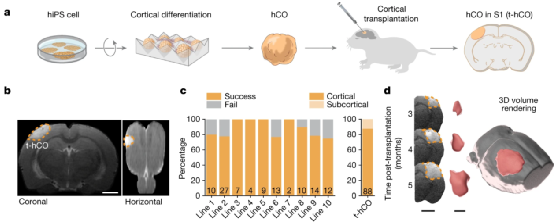
Fig.1 Schematic of the experimental design.
随后,研究人员通过免疫荧光鉴定了t-hCO内的共表达PPP1R17(皮质祖细胞)、NeuN(神经元)、SOX9 和 GFAP(神经胶质细胞)或 PDGFRα(少突胶质祖细胞)等标志的细胞以及血管内皮细胞的存在。表明了hCO的成功诱导分化。
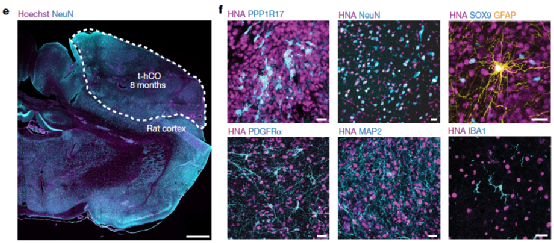
Fig.2 Overview of example t-hCOs in the rat cortex
进一步地,在t-hCOs诱导分化的第8个月,研究人员利用单细胞核转录组测序对t-hCOs内的细胞分群进行了单个细胞层面的分析。单细胞测序结果鉴定了t-hCOs存在的包括深层和表层谷氨酸能神经元、循环祖细胞、少突胶质细胞和星形胶质细胞等细胞。此外,研究人员发现体外培养的hCOs与体内移植生长的t-hCOs之间存在一定的差异性。
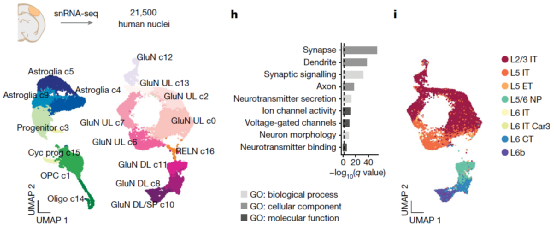
Fig.3 UMAP visualization of all clustered high-quality t-hCO nuclei after Seurat integration
研究人员进一步验证了前述单细胞测序结果的差异是否与体外 hCO 和体内 t-hCOs之间的形态差异有关。结果发现t-hCOs总树突长度比体外 hCO 增加6倍,神经元中的树突棘密度也显著高于 hCO 神经元。电生理学检测表明t-hCOs膜电容升高了 8 倍,静息膜电位更加超极化(约 20 mV),电刺激在 t-hCO 神经元中引起比体外 hCO 神经元更高的放电率。这些电生理特性是与前述t-hCO 更大、更复杂的形态特征一致的。综合来说,在转录、形态和功能分析中,与 hCO 神经元相比,t-hCOs 神经元表现出更为成熟的分化特征。
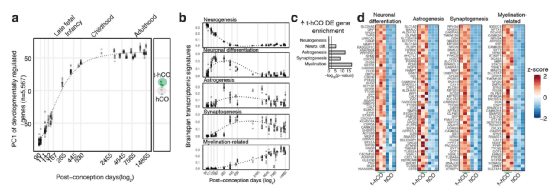
Fig.4 Transplanted hCO RNA-seq comparisons to fetal and adult human cortex.
此外,研究人员还利用前述单细胞测序数据与人类胎儿和成人大脑皮层细胞以及其发育过程中的基因表达数据进行了对比分析。结果表明hCO和t-hCO 在分化 7-8 个月时的整体转录组成熟状态与体内发育时间大致匹配,并且相当于于胎儿晚期;而在形态学上,t-hCOs与人类 L2/3 神经元的相似度更高。
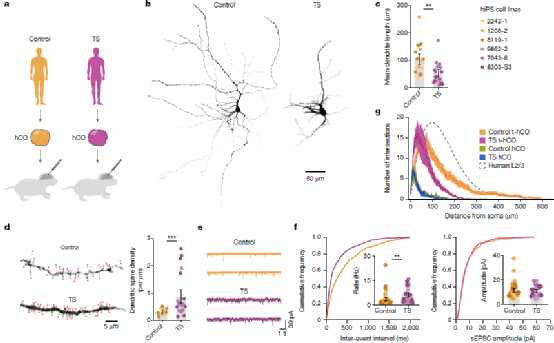
Fig.5 Advanced neuronal features in t-hCO reveal activity-dependent disease phenotypes in human cortical neurons
最后,研究人员验证了t-hCO能否用于精神疾病模型的构建和研究。提摩西综合症(TS)是一种遗传性自闭症相关疾病。研究人员从三名TS患者体和三名正常患者内分离干细胞并诱导分化了hCO,移植后结果表明TS t-hCO 与对照组相比具有异常的树突分支模式,但在类似分化阶段的体外 TS hCO 中则不存在。进一步地,研究人员证明了t-hCO 在解剖学上可以整合到大鼠大脑中,从而能够被宿主大鼠组织激活,并进一步在体内环境中被感觉刺激激活,参与神经环路驱动的行为,实现对大鼠活动的调节功能。
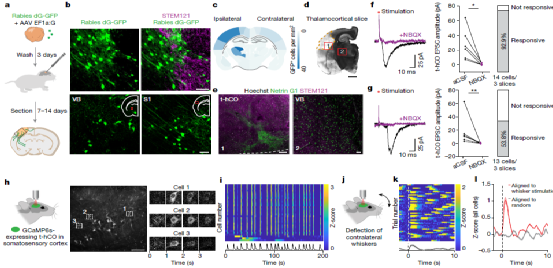
Fig.6 Transplanted hco receive sensory-related inputs.
大脑类器官技术是目前研究神经系统发育和疾病的有力模型,但是缺乏神经环路限制了其发展。在这项Nature的重磅研究中,研究人员耗时7年开发了t-hCO大脑类器官系统,并证明了其在体内可以参与大脑神经环路,从而调节大鼠神经元活动和行为反应。
与之前几项将大脑类器官移植进入动物脑中的研究相比,这项研究有几个突出优势:首先是将大脑类器官移植到出生后3-7天大鼠脑皮层中,有利于类器官在结构和功能的整合;其次是利用MRI长期监测在体大脑类器官的位置和生长情况,从而保证实验的稳定性和可靠性;最后,研究人员植入的是完整类器官而非单细胞悬液,对生物体的伤害较小,有利于皮层神经细胞单元的形成。
同时,没有十全十美的研究。这项研究也存在以下两点不足:一是由于物种和脑部时空差异,即使是早期类器官脑部植入也不能完全模拟人类脑部神经环路发育。二是移植类器官中影响神经环路连接的因素有哪些仍需要确定。这些在未来都需要努力克服的科学问题。
总而言之,这项研究为大脑类器官技术发展研究提供了思路,也为如提摩西综合症(TS)等神经疾病的体外研究、药物开发和治疗策略设计提供了新的模型。
参考文献:
1. Revah, O., Gore, F., Kelley, K.W. et al. Maturation and circuit integration of transplanted human cortical organoids. Nature 610, 319–326 (2022).


尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。