作为肿瘤免疫治疗领域的“明星”疗法,嵌合抗原受体T细胞(CAR-T)已被批准应用于难治性急性B淋巴细胞白血病、复发难治性大B细胞淋巴瘤等多种血液系统肿瘤的治疗[1-2]。
然而,CAR-T疗法在改善肿瘤患者预后的同时,也可能引起不同程度的不良反应。其中40%-60%的患者可出现免疫效应细胞相关神经毒性综合征(ICANS),严重情况下可出现昏迷、癫痫、脑水肿甚至死亡[3-4]。如何早期识别ICANS的高危人群,便成为了摆在临床医生面前的重要问题。
有研究表明,血清神经丝轻链蛋白(NfL)水平与接受CAR-T治疗后出现的ICANS的严重程度相关[5]。但NfL的升高究竟是CAR-T治疗后的急性反应,还是治疗前就已存在的慢性改变,目前暂无定论。NfL与已知的ICANS危险因素之间的关联也有待进一步阐明。
近日,由圣路易斯华盛顿大学西特曼癌症中心Omar H. Butt领衔的团队在JAMA Oncology期刊上发表了一项重要研究成果[6]。
研究发现,与未发生ICANS的患者相比,出现ICANS患者的基线血浆NfL水平较高(87.6 pg/mL vs 29.4 pg/mL,P < 0.001)。
基线NfL水平与ICANS的严重程度相关,但与人口统计学特征、肿瘤史、神经系统非肿瘤性疾病史及神经毒性疗法暴露史等危险因素无关。根据基线NfL水平对患者发生ICANS情况进行预测,其准确度高达96%。
此研究表明,CAR-T细胞输注前的NfL水平可用于预测治疗后ICANS的发生。这一发现也可以帮助临床医生尽早识别ICANS的高危群体,进而为CAR-T疗法的优化和合理应用提供重要参考。

文章题图
为探究在CAR-T治疗过程中患者NfL水平的变化、NfL与ICANS及相关危险因素之间的关联,研究人员回顾性分析了来自圣路易斯华盛顿大学和凯斯西储大学附属医院、接受CD19 CAR-T治疗患者的病历资料,并根据美国移植和细胞治疗学会标准[7],对ICANS和细胞因子释放综合征的严重程度进行划分。
研究者检测了患者基线(淋巴细胞清除前)、淋巴细胞清除时和CAR-T输注第1、3、7、14、30天时的血浆NfL水平,收集了患者淋巴细胞清除时和输注第1、3、5、7天的血小板计数、C反应蛋白等实验室检查结果。
随后,研究人员对不同严重程度的ICANS患者的NfL水平进行了比较,探究了各临床指标与NfL水平的关系,并使用受试者工作特征(ROC)曲线评估了各危险因素预测ICANS的准确性。
研究共纳入了30名患者,中位年龄64岁。与未发生ICANS的患者(29.4 pg/mL)相比,出现任意程度、1-2级和≥3级的ICANS患者的基线NfL均有所升高,分别为87.6 pg/mL, 115.3 pg/mL和71.7 pg/mL。
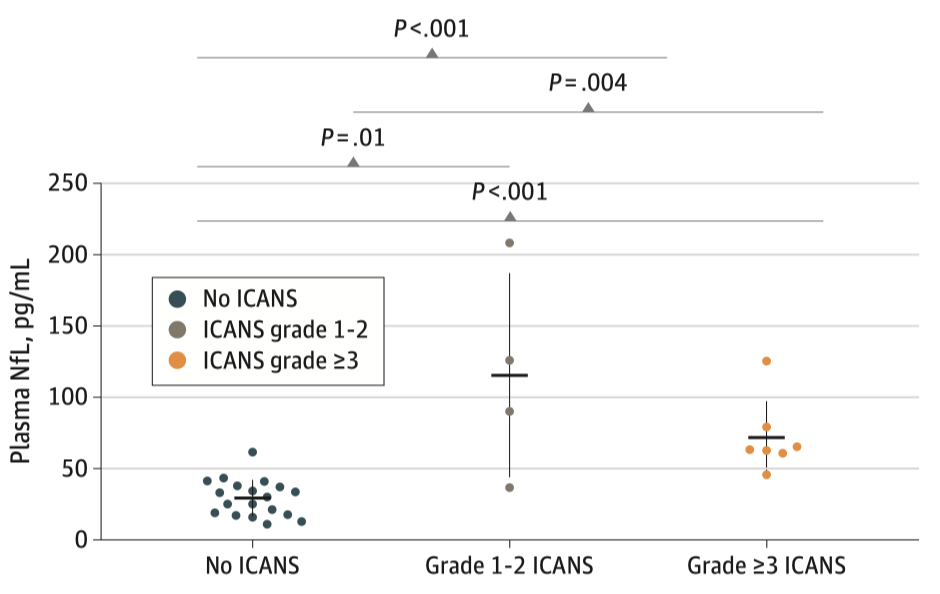
不同等级ICANS患者血浆NfL水平
研究者还发现,在接受CAR-T治疗的过程中,出现ICANS的患者在任意时间点的NfL水平均高于未出现ICANS的患者,且这一趋势持续至细胞输注后第30天。
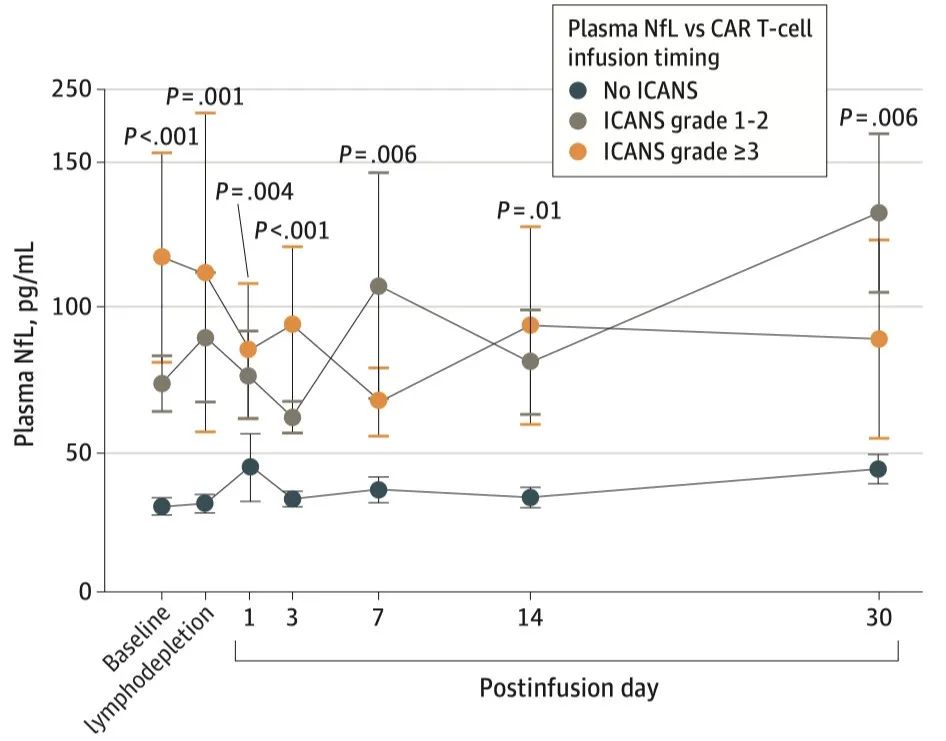
接受CAR-T治疗患者不同时间点血浆NfL水平
此外,患者基线NfL水平与发生ICANS严重程度具有相关性(r = 0.74; P<0.001),但与人口统计学特征、肿瘤史、神经系统非肿瘤性疾病史及神经毒性疗法暴露史等危险因素无关。
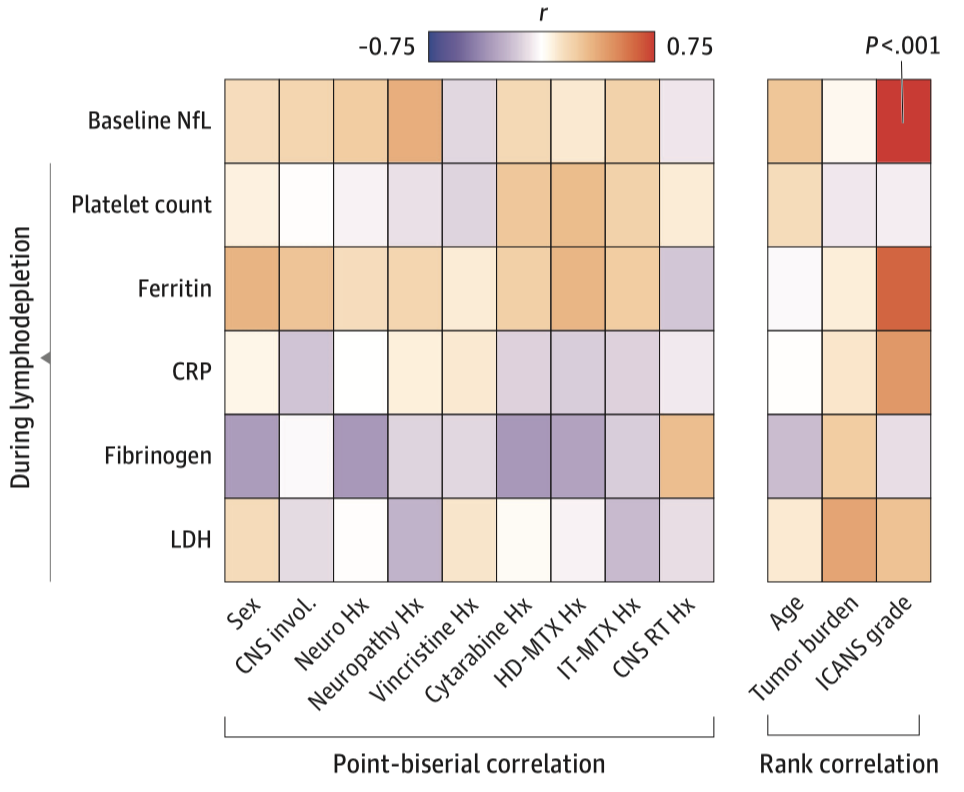
基线NfL与各临床指标相关性分析
根据基线NfL水平对患者发生ICANS情况进行预测,其准确度高达96%(ROC曲线下面积 0.96),灵敏度和特异度则分别为91%和95%,优于其他临床指标。
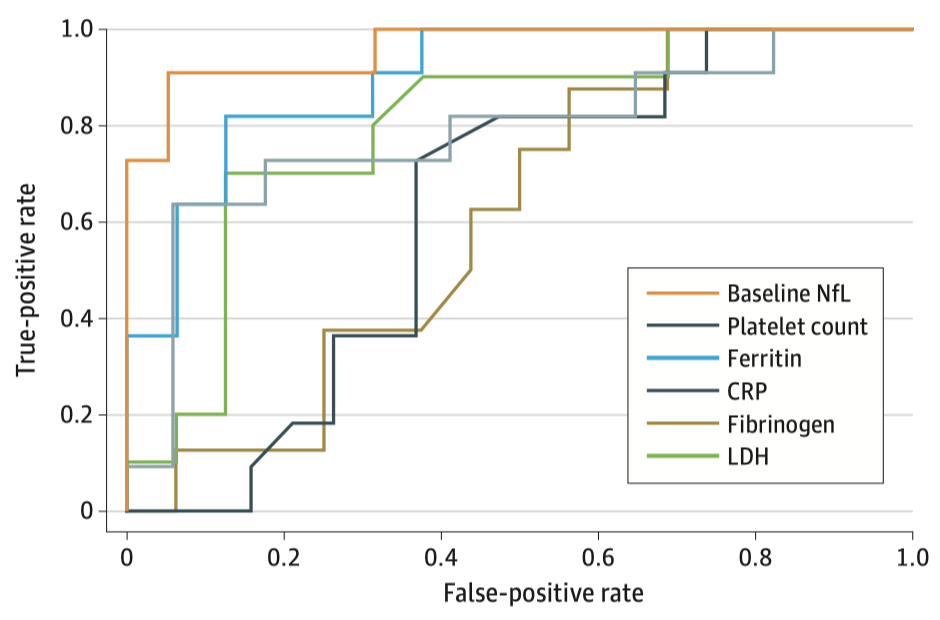
各临床指标预测ICANS准确性比较(橙色为基线NfL)
此研究的样本来源于已注册的临床研究,病历资料及相关数据齐全,研究结论真实可信。根据此研究的结果,CAR-T细胞输注前的NfL水平可用于预测治疗后ICANS的发生。治疗前NfL水平的测定和分析可以帮助临床医生及时识别ICANS的高危群体,采取相关干预措施,继而改善患者预后。
对发生ICANS的患者而言,CAR-T细胞输注前NfL就已经升高,提示这部分患者在治疗前就存在一定程度的神经系统损伤。这一观点也为ICANS的病理生理学和发病机制研究提供了新的切入点。此外,CAR-T细胞输注30天内持续升高的NfL也表明,在ICANS的急性期症状消失后,隐匿的神经损伤依然可能持续存在,其临床意义也值得研究者们进一步分析解读。
本研究也有其局限性,如:纳入研究的大部分患者接受了Axicabtagene Ciloleucel治疗,结论是否同样适用于接受其他CAR-T产品治疗的患者,仍有待进一步研究说明;本研究纳入人数有限,在比较不同等级ICANS之间NfL水平时效力不足;在测定外周血NfL水平时,缺少脑脊液标本及影像学资料作为补充。
参考文献
1. Neelapu SS, Locke FL, Bartlett NL, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. N Engl J Med. Dec 28 2017;377(26):2531-2544. doi:10.1056/NEJMoa1707447
2. Maude SL, Laetsch TW, Buechner J, et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med. Feb 1 2018;378(5):439-448. doi:10.1056/NEJMoa1709866
3. Park JH, Riviere I, Gonen M, et al. Long-Term Follow-up of CD19 CAR Therapy in Acute Lymphoblastic Leukemia. N Engl J Med. Feb 1 2018;378(5):449-459. doi:10.1056/NEJMoa1709919
4. Gust J, Taraseviciute A, Turtle CJ. Neurotoxicity Associated with CD19-Targeted CAR-T Cell Therapies. CNS Drugs. Dec 2018;32(12):1091-1101. doi:10.1007/s40263-018-0582-9
5. Schoeberl F, Tiedt S, Schmitt A, et al. Neurofilament light chain serum levels correlate with the severity of neurotoxicity after CAR T-cell treatment. Blood Adv. May 24 2022;6(10):3022-3026. doi:10.1182/bloodadvances.2021006144
6. Butt OH, Zhou AY, Caimi PF, et al. Assessment of Pretreatment and Posttreatment Evolution of Neurofilament Light Chain Levels in Patients Who Develop Immune Effector Cell-Associated Neurotoxicity Syndrome [published online ahead of print, 2022 Sep 1]. JAMA Oncol. 2022;10.1001/jamaoncol.2022.3738. doi:10.1001/jamaoncol.2022.3738
7. Lee DW, Santomasso BD, Locke FL, et al. ASTCT Consensus Grading for Cytokine Release Syndrome and Neurologic Toxicity Associated with Immune Effector Cells. Biol Blood Marrow Transplant. Apr 2019;25(4):625-638. doi:10.1016/j.bbmt.2018.12.758
尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。