过去十年的关键研究已表明肠道微生物组,即生活在人类消化系统中的成百上千种细菌的集合,影响着神经发育、对癌症免疫疗法的反应以及健康的其他方面。但这些群体是复杂的,如果没有系统的方法来研究其成分,与某些疾病有关的确切细胞和分子仍然是一个谜。
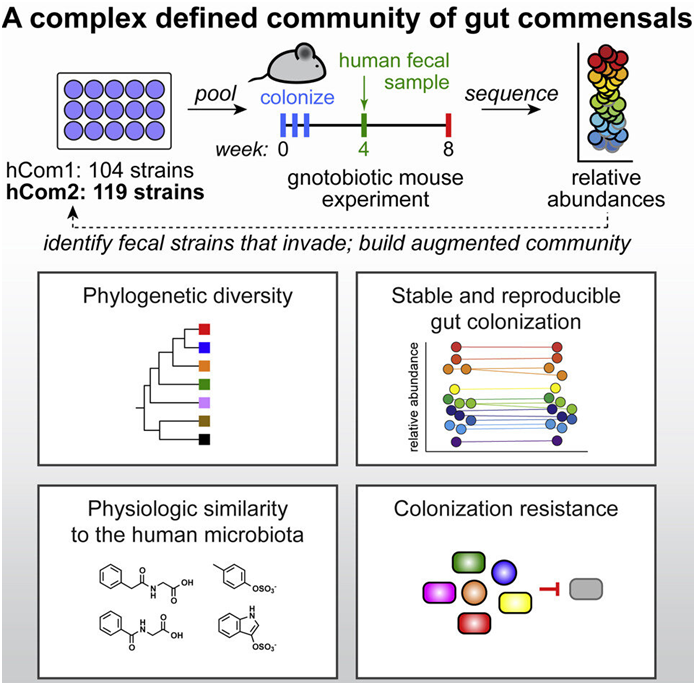
在一项新的研究中,来自美国斯坦福大学的研究人员建立了最复杂和明确定义的合成微生物组(synthetic microbiome),构建出一种由100多种细菌物种组成的细菌群落,并成功将地它们移植到小鼠体内。添加、移除和编辑单个细菌物种的能力将使科学家们更好地了解微生物组与健康之间的联系,并最终开发出一流的微生物组疗法。相关研究结果于2022年9月6日在线发表在Cell期刊上,论文标题为“Design, construction, and in vivo augmentation of a complex gut microbiome”。

许多关键的微生物组研究都是利用粪便移植完成的,它将整个天然的肠道微生物组从一个生物引入另一个生物。虽然科学家们经常沉默一个基因或从一个特定的细胞甚至整个小鼠中移除一种蛋白,但没有这样的一套工具来移除或修改特定粪便样本中的数百种物种。
论文共同通讯作者、斯坦福大学的Michael Fischbach说,“如果不是因为有能力对复杂的生物系统进行分段操纵,我们就不会知道这么多关于生物学的知识。”
Fischbach和其他人看到了一个解决方案:通过单独生长,然后混合其组成的细菌,从头开始建立一种微生物组。
从头构建
微生物组中的每个细胞都占据着一个特定的功能生态位,进行分解和合成分子的反应。为了建立一种微生物组,这些作者必须确保最终的细菌混合物不仅是稳定的,保持平衡,没有任何单一物种压倒其他物种,而且每个物种是功能性的,所有物种一起执行一种完整的天然微生物组的所有行动。鉴于不同物种间的自然差异,选择物种纳入他们的合成微生物组也很困难;随机选择的两个人只有不到一半的微生物基因是相同的。
这些作者决定从最普遍存在的细菌中建立他们的菌落,并求助于人类微生物组计划(Human Microbiome Project, HMP)。HMP是美国国家卫生研究院发起的一项对300多名成年人的完整微生物基因组进行测序的计划。
Fischbach说,“我们正在寻找人类肠道中的细菌物种,试图找到任何个体中几乎总是存在的细菌。”
他们选择了至少在20%的HMP个体中存在的100多种细菌菌株。再加上一些后续研究所需的一些物种,使他们获得了104种细菌物种,每个细菌物种在单独的种群中生长,然后将其混合到一个联合培养物中,形成他们所说的人类群落1(human community one, hCom1)。
尽管对这些菌株能够在实验室中共存感到满意,但真正的测试是他们的新菌落是否会在肠道中扎根。他们将hCom1引入精心设计的没有细菌存在的小鼠体内。hCom1非常稳定,98%的组成物种在这些无菌小鼠的肠道中定植,并且每个新物种的相对丰度水平在两个月内保持不变。
外来入侵
为了使他们的合成微生物组更加完整,这些作者希望确保所有重要的微生物组功能将由一种或多种细菌物种来完成。他们依靠一种称为“定植抗力(colonization resistance)”的理论,该理论指出任何细菌在被引入现有菌落时,只有当它能填补一个尚未被占领的生态位时才能生存。
图片来自Cell, 2022, doi:10.1016/j.cell.2022.08.003。
通过以人类粪便样本的形式向他们的菌落引入完整的微生物组,并跟踪任何新的物种,他们可以建立一个更完整的细菌群落。一些人对这一做法是否可行持怀疑态度。Fischbach说,“hCom1中的细菌物种只在一起生活了几个星期。在这项新的研究中,我们引入了一个已经共存了十年的细菌群落。有些人认为他们会消灭我们的菌落。”值得注意的是,hCom1保持了自己的地位,在最终的细菌群落中只有大约10%的细菌细胞来自于粪便移植。
他们发现了20多种新的细菌物种,在三项粪便移植研究中的至少两项研究中都发现了它们。将这些细菌添加到他们的初始细菌群落中,并去除那些未能在小鼠肠道中扎根的细菌,他们得到了一个由119种细菌物种组成的新细菌群落,他们称之为人类群落2(human community two, hCom2)。这第二次迭代,仍然是通过单独生长然后混合在一起制成的,使小鼠对粪便挑战的抵抗力甚至比第一次更强。
最后的挑战
为了证实他们的合成微生物组的效用,这些作者选择了hCom2定植的小鼠,用大肠杆菌样本对它们进行挑战。这些小鼠和那些接受天然微生物组定植的小鼠一样,抵抗了感染。
先前的研究已表明,健康的天然微生物组会带来保护,但Fischbach及其同事们可以通过反复消除或修改某些菌株来进一步确定哪些菌株会特别带来保护。他们发现了几种关键的细菌,并计划进行进一步研究,以缩小到最关键的物种。
Fischbach认为,hCom2或其未来的版本将使类似的简化研究成为可能,从而揭示出参与其他领域(比如免疫疗法反应)的细菌。Fischbach说,“我们为更广泛的研究界建立了这种合成微生物组。我们想让尽可能多的人得到它,对这个领域产生影响。”
他还设想,这种从头开始构建微生物组的方法将在未来使基于微生物组的工程疗法成为可能。作为斯坦福大学微生物组治疗计划(Microbiome Therapies Initiative, MITI)的负责人,他的目标是构建有朝一日可以移植到人体内以治疗或预防多种疾病的工程化细菌群落。(生物谷 Bioon.com)
参考资料:
Alice G. Cheng et al. Design, construction, and in vivo augmentation of a complex gut microbiome. Cell, 2022, doi:10.1016/j.cell.2022.08.003.

尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。